Struktura atomowa i własności pierwiastków
Ten rozdział omawia podstawowe pojęcia związane ze strukturą atomową, w tym elektrony wewnętrzne, ich cechy i zastosowania.
Podstawowe pojęcia
Aby zrozumieć zachowanie atomów i ich zdolność do tworzenia wiązań chemicznych, niezbędne jest poznanie podstawowych pojęć dotyczących struktury atomowej. Jednym z kluczowych elementów struktury atomu są elektrony wewnętrzne. Eletrony wewnętrzne, często nazywane również elektronami rdzeniowymi, to elektrony znajdujące się na powłokach elektronowych bliższych jądru atomu. W przeciwieństwie do elektronów walencyjnych, które biorą udział w tworzeniu wiązań chemicznych, elektrony wewnętrzne są silnie związane z jądrem i nie uczestniczą w reakcjach chemicznych.
1.1. Struktura atomowa
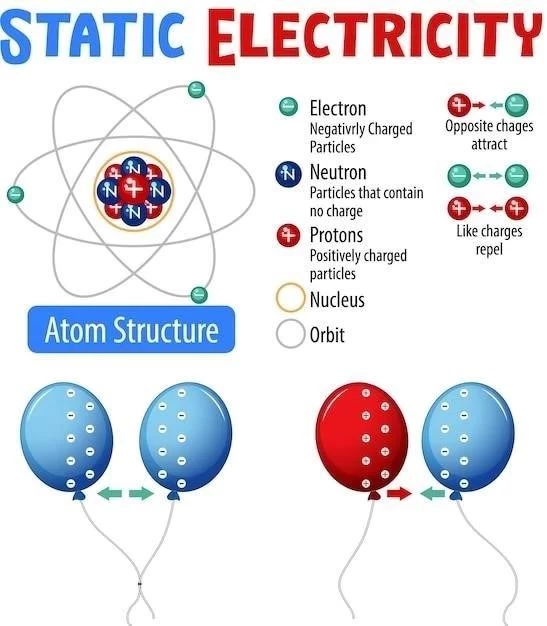
Atom składa się z jądra, które zawiera protony i neutrony, oraz otaczającej je chmury elektronowej. Protony i neutrony są nukleonami, cząstkami o masie atomowej zbliżonej do 1 u. Protony mają ładunek dodatni (+1), neutrony są elektrycznie obojętne, a elektrony mają ładunek ujemny (-1). Liczba protonów w jądrze atomu określa jego liczbę atomową (
1.2. Liczba atomowa i liczba masowa
Liczba atomowa (
1.3. Izotopy
Izotopy to atomy tego samego pierwiastka chemicznego, które mają taką samą liczbę atomową (
Elektronowa konfiguracja atomu
Elektronowa konfiguracja atomu opisuje rozmieszczenie elektronów na poszczególnych powłokach i podpowłokach atomowych. Każdy elektron w atomie jest scharakteryzowany przez cztery liczby kwantowe⁚ główną liczbę kwantową (
2.1. Kwantowe liczby
Cztery liczby kwantowe opisują stan kwantowy każdego elektronu w atomie. Główna liczba kwantowa (
2.2. Zasada Aufbau
Zasada Aufbau, zwana także zasadą budowania, określa kolejność wypełniania orbitali atomowych przez elektrony. Zgodnie z tą zasadą elektrony najpierw zajmują orbitale o najniższej energii. Orbitale o tej samej energii są wypełniane kolejno, zgodnie z zasadą Hunda, która mówi, że elektrony najpierw zajmują oddzielne orbitale o tej samej energii, a dopiero potem sparowują się na jednym orbitalu. W ten sposób można przewidywać elektronową konfigurację atomu, a tym samym jego właściwości chemiczne.
2.3. Zasada Hunda
Zasada Hunda, zwana także regułą Hunda, stanowi uzupełnienie zasady Aufbau i określa kolejność wypełniania orbitali o tej samej energii. Zgodnie z zasadą Hunda, elektrony najpierw zajmują oddzielne orbitale o tej samej energii, a dopiero potem sparowują się na jednym orbitalu. W ten sposób uzyskuje się konfigurację elektronową o maksymalnej liczbie niesparowanych elektronów, co zapewnia większą stabilność atomu. Zasada Hunda ma kluczowe znaczenie dla zrozumienia właściwości magnetycznych atomów i jonów.
2.4. Elektronowa konfiguracja pierwiastków
Elektronowa konfiguracja atomu danego pierwiastka chemicznego jest unikalna i określa jego właściwości chemiczne. Na przykład atom sodu (Na) ma 11 elektronów, które są rozmieszczone na powłokach elektronowych w następujący sposób⁚ 1s22s22p63s1. W tej konfiguracji elektrony wewnętrzne (1s22s22p6) są silnie związane z jądrem, a elektron walencyjny (3s1) jest odpowiedzialny za reaktywność chemiczną sodu. Znajomość elektronowej konfiguracji pierwiastków jest kluczowa dla zrozumienia ich zachowania w reakcjach chemicznych.
Własności okresowe pierwiastków
Własności chemiczne pierwiastków wykazują pewne prawidłowości, które są powiązane z ich położeniem w układzie okresowym. Okresowość własności pierwiastków wynika z powtarzalnego wzorca konfiguracji elektronowej. Wraz ze wzrostem liczby atomowej (
3.1. Energia jonizacji
Energia jonizacji (
3.2. Afinicja elektronowa
Afinicja elektronowa (
3.3. Elektroujemność
Elektroujemność (
3.4. Promień atomowy
Promień atomowy (
3.5. Efekt ekranowania
Efekt ekranowania to osłabienie siły przyciągania elektronów walencyjnych do jądra atomowego przez elektrony wewnętrzne. Elektrony wewnętrzne tworzą ekran, który osłania elektrony walencyjne od pełnego ładunku jądrowego. Im więcej elektronów wewnętrznych, tym silniejszy efekt ekranowania. Efekt ekranowania wpływa na promień atomowy, energię jonizacji i elektroujemność. Im silniejszy efekt ekranowania, tym większy promień atomowy, mniejsza energia jonizacji i mniejsza elektroujemność.
3.6. Skuteczny ładunek jądrowy
Skuteczny ładunek jądrowy (
Chemia kwantowa i spektroskopia
Chemia kwantowa to dziedzina chemii, która wykorzystuje zasady mechaniki kwantowej do opisu struktury i właściwości atomów i cząsteczek. Spektroskopia to dziedzina nauki, która bada oddziaływanie promieniowania elektromagnetycznego z materią; Spektroskopia pozwala na uzyskanie informacji o strukturze, składzie i właściwościach fizycznych i chemicznych substancji. W szczególności spektroskopia fotoelektronowa rentgenowska (XPS) jest techniką, która wykorzystuje promieniowanie rentgenowskie do badania poziomów energetycznych elektronów w atomie. XPS dostarcza informacji o składzie pierwiastkowym, stanie chemicznym i elektronowej strukturze substancji.
4.1. Chemia kwantowa
Chemia kwantowa to dziedzina chemii, która wykorzystuje zasady mechaniki kwantowej do opisu struktury i właściwości atomów i cząsteczek. Mechanika kwantowa opisuje zachowanie materii na poziomie atomowym i subatomowym. Chemia kwantowa dostarcza narzędzi do przewidywania i wyjaśniania właściwości chemicznych, takich jak energia wiązania, geometria cząsteczki, widma absorpcyjne i emisyjne. Metody chemii kwantowej są stosowane w różnych dziedzinach chemii, w tym w chemii teoretycznej, chemii obliczeniowej i spektroskopii.
4.2. Spektroskopia
Spektroskopia to dziedzina nauki, która bada oddziaływanie promieniowania elektromagnetycznego z materią. W spektroskopii analizuje się widmo promieniowania elektromagnetycznego, które jest emitowane lub pochłaniane przez substancję. Analiza widma pozwala na uzyskanie informacji o strukturze, składzie i właściwościach fizycznych i chemicznych substancji. Istnieje wiele różnych technik spektroskopowych, takich jak spektroskopia w podczerwieni (IR), spektroskopia rezonansu magnetycznego jądrowego (NMR), spektroskopia masowa (MS) i spektroskopia fotoelektronowa rentgenowska (XPS).
4.3. Spektroskopia fotoelektronowa rentgenowska (XPS)
Spektroskopia fotoelektronowa rentgenowska (XPS) to technika spektroskopowa, która wykorzystuje promieniowanie rentgenowskie do badania poziomów energetycznych elektronów w atomie. W XPS promieniowanie rentgenowskie pada na próbkę, powodując emisję fotoelektronów. Energia kinetyczna fotoelektronów jest mierzona i wykorzystywana do określenia energii wiązania elektronów w atomie. XPS dostarcza informacji o składzie pierwiastkowym, stanie chemicznym i elektronowej strukturze substancji. XPS jest szeroko stosowana w różnych dziedzinach nauki, w tym w chemii, fizyce, naukach o materiałach i inżynierii.
Związki chemiczne
Związki chemiczne powstają w wyniku połączenia dwóch lub więcej atomów za pomocą wiązań chemicznych. Wiązania chemiczne to siły przyciągania, które utrzymują atomy razem w cząsteczce. Rodzaj wiązania chemicznego, które powstaje między atomami, zależy od ich elektroujemności. Jeśli atomy mają podobną elektroujemność, tworzą wiązanie kowalencyjne, w którym elektrony są współdzielone między atomami. Jeśli atomy mają znacznie różną elektroujemność, tworzą wiązanie jonowe, w którym elektrony są przenoszone z jednego atomu na drugi.
5.1. Rodzaje wiązań chemicznych
Istnieją różne rodzaje wiązań chemicznych, które mogą łączyć atomy w cząsteczki. Najważniejsze typy wiązań to⁚ wiązanie kowalencyjne, wiązanie jonowe, wiązanie wodorowe i wiązanie metaliczne. W wiązaniu kowalencyjnym atomy współdzielą elektrony, tworząc pary elektronowe. W wiązaniu jonowym jeden atom oddaje elektron drugiemu, tworząc jony o przeciwnych ładunkach, które są następnie przyciągane elektrostatycznie. Wiązanie wodorowe to słabsze wiązanie, które powstaje między atomem wodoru, który jest związany z atomem elektroujemnym (np. tlenem, azotem), a innym atomem elektroujemnym. Wiązanie metaliczne występuje między atomami metali i charakteryzuje się delokalizacją elektronów walencyjnych.
5.2. Teoria wiązania walencyjnego
Teoria wiązania walencyjnego (VB) to model, który opisuje tworzenie wiązań chemicznych poprzez nakładanie się orbitali atomowych. Zgodnie z teorią VB, wiązanie kowalencyjne powstaje, gdy dwa atomy dzielą się parą elektronów, które zajmują wspólny orbital. Orbital ten jest utworzony przez nakładanie się orbitali atomowych poszczególnych atomów. Teoria VB pozwala na przewidywanie geometrii cząsteczek i wyjaśnianie niektórych właściwości chemicznych, takich jak energia wiązania i polarność cząsteczek.
5.3. Teoria orbitali molekularnych
Teoria orbitali molekularnych (MO) to model, który opisuje tworzenie wiązań chemicznych poprzez kombinację orbitali atomowych w orbitale molekularne. Orbitale molekularne rozciągają się na wszystkie atomy w cząsteczce i są odpowiedzialne za wiązanie chemiczne. Teoria MO pozwala na wyjaśnienie niektórych właściwości chemicznych, które nie są wyjaśnione przez teorię VB, takich jak magnetyzm cząsteczek i widma absorpcyjne. Teoria MO jest bardziej złożona niż teoria VB, ale dostarcza bardziej kompletny opis wiązań chemicznych.
Reaktywność chemiczna
Reaktywność chemiczna to zdolność substancji do uczestniczenia w reakcjach chemicznych. Reaktywność chemiczna jest związana z elektronową strukturą atomów i cząsteczek. Atomy o niesparowanych elektronach walencyjnych są bardziej reaktywne niż atomy o sparowanych elektronach walencyjnych. Elektrony walencyjne są odpowiedzialne za tworzenie wiązań chemicznych, a ich rozmieszczenie w atomie wpływa na reaktywność substancji. Znajomość elektronowej konfiguracji atomu pozwala na przewidywanie reaktywności chemicznej substancji.
6.1. Wpływ struktury elektronowej na reaktywność
Struktura elektronowa atomu, a w szczególności rozmieszczenie elektronów walencyjnych, ma kluczowe znaczenie dla reaktywności chemicznej. Atomy o niesparowanych elektronach walencyjnych są bardziej reaktywne, ponieważ łatwiej im tworzyć wiązania chemiczne. Na przykład atomy metali, które mają jeden lub dwa elektrony walencyjne, są bardziej reaktywne niż atomy niemetali, które mają więcej elektronów walencyjnych. Ponadto, energia jonizacji i elektroujemność atomu wpływają na jego reaktywność. Atomy o niskiej energii jonizacji i wysokiej elektroujemności są bardziej reaktywne.
6.2. Reakcje chemiczne
Reakcje chemiczne to procesy, w których dochodzi do przegrupowania atomów i cząsteczek, prowadzące do powstania nowych substancji. Reakcje chemiczne mogą być opisane równaniami chemicznymi, które przedstawiają symbole pierwiastków i cząsteczek reagujących i produktów; Reakcje chemiczne mogą być egzotermiczne, jeśli uwalniają ciepło, lub endotermiczne, jeśli pochłaniają ciepło. Reakcje chemiczne mogą być odwracalne lub nieodwracalne, w zależności od warunków reakcji.
6.3. Kinetyka i termodynamika reakcji
Kinetyka chemiczna bada szybkość reakcji chemicznych i czynniki, które na nią wpływają. Termodynamika chemiczna zajmuje się badaniem przepływu energii w reakcjach chemicznych. Kinetyka i termodynamika reakcji są ze sobą powiązane, ponieważ szybkość reakcji zależy od jej termodynamicznej opłacalności. Reakcje, które są termodynamicznie korzystne (tj. mają ujemną zmianę energii swobodnej Gibbsa), mogą zachodzić szybko lub wolno, w zależności od czynników kinetycznych, takich jak energia aktywacji.
Artykuł stanowi wartościowe wprowadzenie do tematyki struktury atomowej. Autor w sposób jasny i zwięzły przedstawia podstawowe pojęcia, takie jak elektrony wewnętrzne, liczba atomowa i liczba masowa. Szczególnie cenne jest uwzględnienie przykładów, które ułatwiają przyswojenie omawianych zagadnień. Niewątpliwym atutem jest również zastosowanie symboli chemicznych i oznaczeń, które wzbogacają tekst i czynią go bardziej przejrzystym.
Artykuł stanowi wartościowe wprowadzenie do tematyki struktury atomowej i własności pierwiastków. Prezentacja podstawowych pojęć, takich jak elektrony wewnętrzne, liczba atomowa i liczba masowa, jest klarowna i zrozumiała. Szczególnie cenne jest uwzględnienie przykładów, które ułatwiają przyswojenie omawianych zagadnień. Niewątpliwym atutem jest również zastosowanie symboli chemicznych i oznaczeń, które wzbogacają tekst i czynią go bardziej przejrzystym.
Artykuł stanowi dobry punkt wyjścia do zgłębiania wiedzy o strukturze atomowej. Autor w sposób przystępny i logiczny omawia podstawowe pojęcia, takie jak liczba atomowa, liczba masowa i izotopy. Szczególnie wartościowe jest uwzględnienie przykładów, które ułatwiają zrozumienie omawianych zagadnień. Niewątpliwym atutem jest również zastosowanie symboli chemicznych i oznaczeń, które wzbogacają tekst i czynią go bardziej przejrzystym.
Autor artykułu w sposób jasny i zwięzły przedstawia podstawowe pojęcia związane ze strukturą atomową. Wyjaśnienie różnicy między elektronami wewnętrznymi a elektronami walencyjnymi jest szczególnie cenne dla zrozumienia chemii. Dodatkowo, artykuł zawiera przystępne definicje liczby atomowej i liczby masowej, co ułatwia przyswojenie tych kluczowych pojęć.
Artykuł stanowi cenne źródło informacji o strukturze atomowej i własnościach pierwiastków. Autor w sposób klarowny i zwięzły przedstawia podstawowe pojęcia, takie jak elektrony wewnętrzne, liczba atomowa i liczba masowa. Szczególnie wartościowe jest uwzględnienie przykładów, które ułatwiają zrozumienie omawianych zagadnień. Niewątpliwym atutem jest również zastosowanie symboli chemicznych i oznaczeń, które wzbogacają tekst i czynią go bardziej przejrzystym.