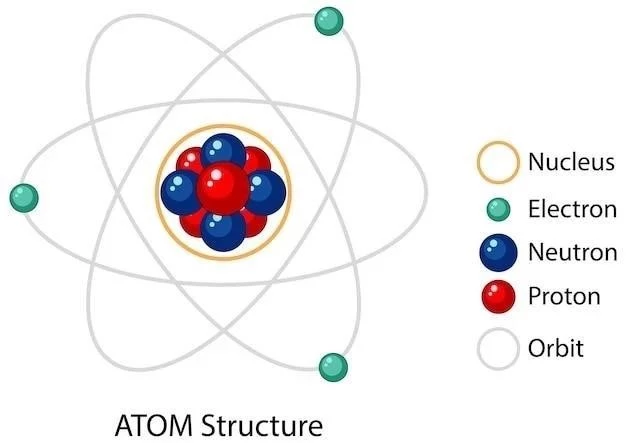
Introducción
Orbital atomowy jest regionem przestrzeni wokół jądra atomu‚ gdzie prawdopodobieństwo znalezienia elektronu jest największe. Orbital atomowy jest opisany przez funkcję falową‚ której rozwiązanie uzyskuje się poprzez zastosowanie równania Schrödingera.
Estructura atómica y mecánica cuántica
Zrozumienie orbitali atomowych wymaga znajomości podstawowej struktury atomu oraz mechaniki kwantowej‚ która opisuje zachowanie elektronów w atomach.
2.1. Modelo atómico de Bohr
Model atomowy Bohra‚ przedstawiony w 1913 roku‚ był pierwszym modelem atomu‚ który wyjaśniał widmo emisyjne wodoru. Zakładał on‚ że elektrony krążą wokół jądra atomowego po określonych orbitach‚ zwanych poziomami energetycznymi‚ i mogą przechodzić między nimi tylko poprzez absorpcję lub emisję kwantu energii. Model Bohra był w stanie wyjaśnić widmo wodoru‚ ale miał pewne ograniczenia‚ np. nie mógł wyjaśnić widm atomów wieloelektronowych.
2.2. Mecánica cuántica y la ecuación de Schrödinger
Mechanika kwantowa‚ rozwinięta na początku XX wieku‚ dostarczyła bardziej precyzyjnego opisu zachowania elektronów w atomach. Kluczowym elementem mechaniki kwantowej jest równanie Schrödingera‚ które opisuje ewolucję w czasie funkcji falowej elektronu. Rozwiązanie tego równania daje nam funkcję falową‚ która zawiera informacje o prawdopodobieństwie znalezienia elektronu w danym punkcie przestrzeni. To prawdopodobieństwo jest przedstawione przez kwadrat funkcji falowej‚ czyli gęstość prawdopodobieństwa;
2.3. Números cuánticos
W mechanice kwantowej stan elektronu w atomie jest opisany przez cztery liczby kwantowe⁚
- liczba kwantowa główna (n)
- liczba kwantowa azimutalna lub orbitalna (l)
- liczba kwantowa magnetyczna (ml)
- liczba kwantowa spinowa (ms)
2.3.1. Número cuántico principal (n)
Liczba kwantowa główna (n) określa poziom energetyczny elektronu w atomie. Może przyjmować wartości całkowite⁚ 1‚ 2‚ 3‚ … Im wyższa wartość n‚ tym wyższy poziom energetyczny i tym dalej od jądra atomu znajduje się elektron. Poziomy energetyczne są często oznaczane literami⁚ K (n=1)‚ L (n=2)‚ M (n=3) itd. Elektrony o tej samej wartości n tworzą powłokę elektronową.
2.3;2. Número cuántico azimutal o angular (l)
Liczba kwantowa azimutalna lub orbitalna (l) określa kształt orbitalu atomowego. Może przyjmować wartości od 0 do n-1. l = 0 odpowiada orbitalowi s‚ który ma kształt kulisty. l = 1 odpowiada orbitalowi p‚ który ma kształt hantli. l = 2 odpowiada orbitalowi d‚ który ma bardziej złożony kształt. l = 3 odpowiada orbitalowi f‚ który ma jeszcze bardziej złożony kształt. Orbitaly o tej samej wartości l tworzą podpowłokę elektronową.
2.3.3. Número cuántico magnético (ml)
Liczba kwantowa magnetyczna (ml) określa orientację orbitalu atomowego w przestrzeni. Może przyjmować wartości od -l do +l‚ włącznie z 0. Na przykład‚ dla l = 1 (orbital p)‚ ml może przyjmować wartości -1‚ 0 i +1‚ co odpowiada trzem różnym orientacjom orbitalu p w przestrzeni⁚ px‚ py i pz. Orbitaly o tej samej wartości l i n tworzą podpowłokę elektronową.
2.3.4. Número cuántico de espín (ms)
Liczba kwantowa spinowa (ms) opisuje moment pędu własnego elektronu‚ który jest nazywany spinem. Elektron zachowuje się jak mały magnes‚ który może być zorientowany w górę lub w dół. ms może przyjmować wartości +1/2 lub -1/2‚ co odpowiada spinowi “w górę” lub “w dół”. Spin elektronu jest ważny dla zrozumienia wiązania chemicznego i właściwości magnetycznych substancji.
Orbitales atómicos
Orbital atomowy jest regionem przestrzeni wokół jądra atomu‚ gdzie prawdopodobieństwo znalezienia elektronu jest największe.
3.1. Descripción de los orbitales atómicos
Orbital atomowy jest opisany przez funkcję falową‚ która jest rozwiązaniem równania Schrödingera dla danego atomu. Funkcja falowa zawiera informacje o prawdopodobieństwie znalezienia elektronu w danym punkcie przestrzeni. Kwadrat funkcji falowej‚ czyli gęstość prawdopodobieństwa‚ reprezentuje prawdopodobieństwo znalezienia elektronu w danym punkcie przestrzeni. Orbital atomowy nie jest orbitą‚ jak w modelu Bohra‚ ale raczej obszarem przestrzeni‚ gdzie prawdopodobieństwo znalezienia elektronu jest największe.
3.2. Tipos de orbitales atómicos
Orbitali atomowe są klasyfikowane według ich kształtu i energii. Istnieją cztery główne typy orbitali atomowych⁚
- Orbitali s
- Orbitali p
- Orbitali d
- Orbitali f
3.2.1. Orbitales s
Orbital s ma kształt kulisty i jest symetryczny względem jądra atomowego. Istnieje tylko jeden orbital s na każdym poziomie energetycznym. Orbital s jest zazwyczaj najniższym poziomem energetycznym w atomie. Na przykład‚ orbital 1s jest najniższym poziomem energetycznym w atomie wodoru. Orbital 2s jest drugim najniższym poziomem energetycznym w atomie helu.
3.2.2. Orbitales p
Orbital p ma kształt hantli i jest zorientowany wzdłuż jednej z trzech osi przestrzennych⁚ x‚ y lub z. Istnieją trzy orbitali p na każdym poziomie energetycznym (po jednym dla każdej osi). Orbitali p są zazwyczaj wyższym poziomem energetycznym niż orbitali s na tym samym poziomie energetycznym. Na przykład‚ orbitali 2p są wyższym poziomem energetycznym niż orbital 2s w atomie węgla.
3.2.3. Orbitales d
Orbitali d mają bardziej złożony kształt niż orbitali s i p. Istnieje pięć orbitali d na każdym poziomie energetycznym. Orbitali d są zazwyczaj wyższym poziomem energetycznym niż orbitali p na tym samym poziomie energetycznym. Orbitali d są zaangażowane w tworzenie wiązań chemicznych w atomach metali przejściowych. Na przykład‚ orbitali 3d w atomie żelaza są zaangażowane w tworzenie wiązań chemicznych w cząsteczce tlenku żelaza (FeO).
3.2.4. Orbitales f
Orbitali f mają jeszcze bardziej złożony kształt niż orbitali d. Istnieje siedem orbitali f na każdym poziomie energetycznym. Orbitali f są zazwyczaj wyższym poziomem energetycznym niż orbitali d na tym samym poziomie energetycznym. Orbitali f są zaangażowane w tworzenie wiązań chemicznych w atomach lantanowców i aktynowców. Na przykład‚ orbitali 4f w atomie ceru są zaangażowane w tworzenie wiązań chemicznych w cząsteczce tlenku ceru (CeO2).
Configuración electrónica
Konfiguracja elektronowa atomu opisuje rozmieszczenie elektronów na poszczególnych orbitalach atomowych.
4.1. Principio de Aufbau
Zasada Aufbau (od niemieckiego “Aufbauprinzip”‚ oznaczającego “zasada budowy”) mówi‚ że elektrony są stopniowo dodawane do orbitali atomowych w kolejności rosnącej energii. Najpierw wypełniane są orbitali o niższej energii‚ a następnie orbitali o wyższej energii. Kolejność wypełniania orbitali jest określona przez diagramu energetycznego orbitali atomowych‚ który pokazuje wzrost energii orbitali. Diagram ten jest narzędziem do przewidywania konfiguracji elektronowej atomów.
4.2. Regla de Hund
Zasada Hunda‚ sformułowana przez niemieckiego fizyka Friedricha Hunda‚ mówi‚ że w obrębie danej podpowłoki elektronowej elektrony najpierw zajmują oddzielne orbitali‚ a następnie dopiero sparowują się na tych samych orbitalach. Zasada ta wynika z minimalizacji odpychania elektrostatycznego między elektronami. W przypadku‚ gdy podpowłoka elektronowa zawiera wiele orbitali o tej samej energii‚ elektrony najpierw zajmują te orbitali pojedynczo‚ z równoległymi spinami‚ a dopiero potem sparowują się na tych samych orbitalach.
4.3. Principio de exclusión de Pauli
Zasada Pauliego‚ sformułowana przez austriackiego fizyka Wolfganga Pauliego‚ mówi‚ że w atomie nie mogą istnieć dwa elektrony o tych samych czterech liczbach kwantowych. Innymi słowy‚ na każdym orbitalu atomowym mogą znajdować się maksymalnie dwa elektrony‚ które muszą mieć przeciwne spiny. Zasada Pauliego jest podstawą dla zrozumienia struktury elektronowej atomów i cząsteczek.
Hibridación de orbitales atómicos
Hybrydyzacja orbitali atomowych to proces mieszania się orbitali atomowych tego samego atomu w celu utworzenia nowych orbitali hybrydowych.
5.1. Concepto de hibridación
Hybrydyzacja orbitali atomowych jest teoretycznym modelem‚ który wyjaśnia kształt i wiązanie cząsteczek. Model ten zakłada‚ że orbitali atomowe o różnych kształtach i energiach mogą się mieszać‚ tworząc nowe orbitali o jednakowych energiach i kształtach. Orbitali hybrydowe są bardziej ukierunkowane w przestrzeni niż orbitali atomowe‚ co pozwala na tworzenie silniejszych wiązań chemicznych.
5.2. Tipos de hibridación
Istnieje kilka rodzajów hybrydyzacji orbitali atomowych‚ w zależności od liczby i typu orbitali‚ które się mieszają. Najczęstsze rodzaje hybrydyzacji to⁚
- Hybrydyzacja sp3
- Hybrydyzacja sp2
- Hybrydyzacja sp
5.2.1. Hibridación sp3
Hybrydyzacja sp3 występuje‚ gdy jeden orbital s i trzy orbitali p atomu mieszają się ze sobą‚ tworząc cztery identyczne orbitali hybrydowe sp3. Orbitali hybrydowe sp3 są ukierunkowane tetraedrycznie‚ tworząc kąt 109‚5° między sobą. Hybrydyzacja sp3 jest typowa dla atomów węgla w alkanach‚ takich jak metan (CH4).
5.2.2. Hibridación sp2
Hybrydyzacja sp2 występuje‚ gdy jeden orbital s i dwa orbitali p atomu mieszają się ze sobą‚ tworząc trzy identyczne orbitali hybrydowe sp2. Orbitali hybrydowe sp2 są ukierunkowane płasko‚ tworząc kąt 120° między sobą. Pozostały orbital p pozostaje niehybrydyzowany i jest prostopadły do płaszczyzny utworzonej przez orbitali hybrydowe sp2. Hybrydyzacja sp2 jest typowa dla atomów węgla w alkenach‚ takich jak etylen (C2H4).
5.2.3. Hibridación sp
Hybrydyzacja sp występuje‚ gdy jeden orbital s i jeden orbital p atomu mieszają się ze sobą‚ tworząc dwa identyczne orbitali hybrydowe sp. Orbitali hybrydowe sp są ukierunkowane liniowo‚ tworząc kąt 180° między sobą. Pozostałe dwa orbitali p pozostają niehybrydyzowane i są prostopadłe do osi utworzonej przez orbitali hybrydowe sp. Hybrydyzacja sp jest typowa dla atomów węgla w alkinach‚ takich jak acetylen (C2H2).
Ejemplos de hibridación
Poniżej przedstawiono przykłady hybrydyzacji orbitali atomowych w cząsteczkach organicznych.
6.1. Metano (CH4)
W metanie (CH4) atom węgla ulega hybrydyzacji sp3. Atom węgla ma cztery elektrony walencyjne‚ które znajdują się na orbitalach 2s i 2p. W procesie hybrydyzacji sp3 jeden orbital 2s i trzy orbitali 2p mieszają się ze sobą‚ tworząc cztery identyczne orbitali hybrydowe sp3. Każdy orbital hybrydowy sp3 zawiera jeden elektron i jest ukierunkowany tetraedrycznie‚ tworząc kąt 109‚5° między sobą; Cztery orbitali hybrydowe sp3 tworzą cztery wiązania kowalencyjne z czterema atomami wodoru‚ tworząc cząsteczkę metanu o strukturze tetraedrycznej.
6.2. Etileno (C2H4)
W etylenie (C2H4) każdy atom węgla ulega hybrydyzacji sp2. Atom węgla ma cztery elektrony walencyjne‚ które znajdują się na orbitalach 2s i 2p. W procesie hybrydyzacji sp2 jeden orbital 2s i dwa orbitali 2p mieszają się ze sobą‚ tworząc trzy identyczne orbitali hybrydowe sp2. Każdy orbital hybrydowy sp2 zawiera jeden elektron i jest ukierunkowany płasko‚ tworząc kąt 120° między sobą. Pozostały orbital 2p pozostaje niehybrydyzowany i jest prostopadły do płaszczyzny utworzonej przez orbitali hybrydowe sp2. Dwa atomy węgla w etylenie łączą się ze sobą poprzez wiązanie podwójne‚ które składa się z jednego wiązania sigma (σ) utworzonego przez nakładanie się orbitali hybrydowych sp2 i jednego wiązania pi (π) utworzonego przez nakładanie się orbitali p niehybrydyzowanych.
6.3. Acetileno (C2H2)
W acetylenie (C2H2) każdy atom węgla ulega hybrydyzacji sp. Atom węgla ma cztery elektrony walencyjne‚ które znajdują się na orbitalach 2s i 2p. W procesie hybrydyzacji sp jeden orbital 2s i jeden orbital 2p mieszają się ze sobą‚ tworząc dwa identyczne orbitali hybrydowe sp. Każdy orbital hybrydowy sp zawiera jeden elektron i jest ukierunkowany liniowo‚ tworząc kąt 180° między sobą. Pozostałe dwa orbitali 2p pozostają niehybrydyzowane i są prostopadłe do osi utworzonej przez orbitali hybrydowe sp. Dwa atomy węgla w acetylenie łączą się ze sobą poprzez wiązanie potrójne‚ które składa się z jednego wiązania sigma (σ) utworzonego przez nakładanie się orbitali hybrydowych sp i dwóch wiązań pi (π) utworzonych przez nakładanie się orbitali p niehybrydyzowanych.
Conclusiones
Orbitali atomowe są podstawowym elementem chemii kwantowej i są niezbędne do zrozumienia struktury i wiązania cząsteczek. Hybrydyzacja orbitali atomowych to model teoretyczny‚ który wyjaśnia kształt i wiązanie cząsteczek‚ pozwalając na przewidywanie ich właściwości. Zrozumienie hybrydyzacji orbitali atomowych jest kluczowe dla zrozumienia reakcji chemicznych i tworzenia nowych materiałów.