Model atomowy Schrödingera, opracowany w 1926 roku przez Erwina Schrödingera, stanowi przełomowy krok w rozwoju fizyki atomowej, zastępując model Bohra i wprowadzając nową koncepcję opisu atomu opartą na mechanice kwantowej.
Zrozumienie budowy atomu stanowiło od wieków jedno z najważniejszych wyzwań dla fizyki. Początkowo, w XIX wieku, dominował model atomu jako niepodzielnej, stałej cząstki. Jednak odkrycia fizyki atomowej, takie jak zjawisko promieniotwórczości i widma emisyjnego, zmusiły naukowców do rewizji tego poglądu. Pierwszym modelem atomowym, który uwzględniał strukturę wewnętrzną atomu, był model atomowy Thomsona, zaproponowany w 1904 roku. Model ten zakładał, że atom jest sferą naładowaną dodatnio, w której osadzone są elektrony o ładunku ujemnym. Jednak model Thomsona nie potrafił wyjaśnić stabilności atomu i istnienia widma emisyjnego.
Przełom w fizyce atomowej nastąpił w 1913 roku, kiedy Niels Bohr opublikował swój model atomowy. Model Bohra opierał się na założeniu, że elektrony poruszają się po orbitach wokół jądra atomowego, a ich energia jest skwantowana, co oznacza, że może przyjmować tylko dyskretne wartości. Model Bohra wyjaśniał widmo emisyjne atomu wodoru, ale miał też swoje ograniczenia, nie wyjaśniając np. widm atomów wieloelektronowych.
Zrozumienie budowy atomu stanowiło od wieków jedno z najważniejszych wyzwań dla fizyki. Początkowo, w XIX wieku, dominował model atomu jako niepodzielnej, stałej cząstki. Jednak odkrycia fizyki atomowej, takie jak zjawisko promieniotwórczości i widma emisyjnego, zmusiły naukowców do rewizji tego poglądu. Pierwszym modelem atomowym, który uwzględniał strukturę wewnętrzną atomu, był model atomowy Thomsona, zaproponowany w 1904 roku. Model ten zakładał, że atom jest sferą naładowaną dodatnio, w której osadzone są elektrony o ładunku ujemnym. Jednak model Thomsona nie potrafił wyjaśnić stabilności atomu i istnienia widma emisyjnego.
Przełom w fizyce atomowej nastąpił w 1913 roku, kiedy Niels Bohr opublikował swój model atomowy. Model Bohra opierał się na założeniu, że elektrony poruszają się po orbitach wokół jądra atomowego, a ich energia jest skwantowana, co oznacza, że może przyjmować tylko dyskretne wartości. Model Bohra wyjaśniał widmo emisyjne atomu wodoru, ale miał też swoje ograniczenia, nie wyjaśniając np. widm atomów wieloelektronowych.
Model atomowy Bohra, mimo swojego sukcesu w wyjaśnieniu widma atomu wodoru, miał jednak swoje ograniczenia. Nie potrafił on wyjaśnić widm atomów wieloelektronowych, a także nie uwzględniał istotnych aspektów zachowania elektronów w atomie. Model Bohra zakładał, że elektrony poruszają się po określonych orbitach wokół jądra, co jest sprzeczne z zasadą nieoznaczoności Heisenberga, która stwierdza, że nie można jednocześnie określić z dokładnością położenia i pędu cząstki. Ponadto, model Bohra nie potrafił wyjaśnić zjawiska spinu elektronu ani istnienia orbitali atomowych.
Ograniczenia modelu atomowego Bohra stworzyły potrzebę opracowania nowego modelu atomu, który byłby w stanie wyjaśnić wszystkie znane wtedy zjawiska fizyczne związane z budową atomu. Te nowe wyzwania doprowadziły do rozwoju mechaniki kwantowej, która stała się podstawą do opracowania nowego modelu atomu, znanego jako model atomowy Schrödingera.
Zrozumienie budowy atomu stanowiło od wieków jedno z najważniejszych wyzwań dla fizyki. Początkowo, w XIX wieku, dominował model atomu jako niepodzielnej, stałej cząstki. Jednak odkrycia fizyki atomowej, takie jak zjawisko promieniotwórczości i widma emisyjnego, zmusiły naukowców do rewizji tego poglądu. Pierwszym modelem atomowym, który uwzględniał strukturę wewnętrzną atomu, był model atomowy Thomsona, zaproponowany w 1904 roku. Model ten zakładał, że atom jest sferą naładowaną dodatnio, w której osadzone są elektrony o ładunku ujemnym. Jednak model Thomsona nie potrafił wyjaśnić stabilności atomu i istnienia widma emisyjnego.
Przełom w fizyce atomowej nastąpił w 1913 roku, kiedy Niels Bohr opublikował swój model atomowy. Model Bohra opierał się na założeniu, że elektrony poruszają się po orbitach wokół jądra atomowego, a ich energia jest skwantowana, co oznacza, że może przyjmować tylko dyskretne wartości. Model Bohra wyjaśniał widmo emisyjne atomu wodoru, ale miał też swoje ograniczenia, nie wyjaśniając np. widm atomów wieloelektronowych.
Model atomowy Bohra, mimo swojego sukcesu w wyjaśnieniu widma atomu wodoru, miał jednak swoje ograniczenia. Nie potrafił on wyjaśnić widm atomów wieloelektronowych, a także nie uwzględniał istotnych aspektów zachowania elektronów w atomie. Model Bohra zakładał, że elektrony poruszają się po określonych orbitach wokół jądra, co jest sprzeczne z zasadą nieoznaczoności Heisenberga, która stwierdza, że nie można jednocześnie określić z dokładnością położenia i pędu cząstki. Ponadto, model Bohra nie potrafił wyjaśnić zjawiska spinu elektronu ani istnienia orbitali atomowych.
Ograniczenia modelu atomowego Bohra stworzyły potrzebę opracowania nowego modelu atomu, który byłby w stanie wyjaśnić wszystkie znane wtedy zjawiska fizyczne związane z budową atomu. Te nowe wyzwania doprowadziły do rozwoju mechaniki kwantowej, która stała się podstawą do opracowania nowego modelu atomu, znanego jako model atomowy Schrödingera.
Mechanika kwantowa, rozwijana na początku XX wieku, zrewolucjonizowała nasze rozumienie świata atomowego. Kluczowe dla mechaniki kwantowej są dwa fundamentalne pojęcia⁚ dualizm korpuskularno-falowy i zasada nieoznaczoności Heisenberga. Dualizm korpuskularno-falowy, sformułowany przez de Brogliego, stwierdza, że cząstki, takie jak elektrony, wykazują zarówno właściwości falowe, jak i korpuskularne. Oznacza to, że elektrony mogą zachowywać się jak fale, rozprzestrzeniając się w przestrzeni, a jednocześnie jak cząstki, posiadające określoną masę i ładunek.
Zasada nieoznaczoności Heisenberga stwierdza, że nie można jednocześnie określić z dowolną dokładnością położenia i pędu cząstki. Oznacza to, że im dokładniej znamy położenie cząstki, tym mniej precyzyjnie znamy jej pęd, i odwrotnie. Zasada ta ma fundamentalne znaczenie dla mechaniki kwantowej, ponieważ pokazuje, że nie można opisać ruchu cząstki w sposób deterministyczny, tak jak w mechanice klasycznej.
Zrozumienie budowy atomu stanowiło od wieków jedno z najważniejszych wyzwań dla fizyki. Początkowo, w XIX wieku, dominował model atomu jako niepodzielnej, stałej cząstki. Jednak odkrycia fizyki atomowej, takie jak zjawisko promieniotwórczości i widma emisyjnego, zmusiły naukowców do rewizji tego poglądu. Pierwszym modelem atomowym, który uwzględniał strukturę wewnętrzną atomu, był model atomowy Thomsona, zaproponowany w 1904 roku. Model ten zakładał, że atom jest sferą naładowaną dodatnio, w której osadzone są elektrony o ładunku ujemnym. Jednak model Thomsona nie potrafił wyjaśnić stabilności atomu i istnienia widma emisyjnego.
Przełom w fizyce atomowej nastąpił w 1913 roku, kiedy Niels Bohr opublikował swój model atomowy. Model Bohra opierał się na założeniu, że elektrony poruszają się po orbitach wokół jądra atomowego, a ich energia jest skwantowana, co oznacza, że może przyjmować tylko dyskretne wartości. Model Bohra wyjaśniał widmo emisyjne atomu wodoru, ale miał też swoje ograniczenia, nie wyjaśniając np. widm atomów wieloelektronowych.
Model atomowy Bohra, mimo swojego sukcesu w wyjaśnieniu widma atomu wodoru, miał jednak swoje ograniczenia. Nie potrafił on wyjaśnić widm atomów wieloelektronowych, a także nie uwzględniał istotnych aspektów zachowania elektronów w atomie. Model Bohra zakładał, że elektrony poruszają się po określonych orbitach wokół jądra, co jest sprzeczne z zasadą nieoznaczoności Heisenberga, która stwierdza, że nie można jednocześnie określić z dokładnością położenia i pędu cząstki. Ponadto, model Bohra nie potrafił wyjaśnić zjawiska spinu elektronu ani istnienia orbitali atomowych.
Ograniczenia modelu atomowego Bohra stworzyły potrzebę opracowania nowego modelu atomu, który byłby w stanie wyjaśnić wszystkie znane wtedy zjawiska fizyczne związane z budową atomu. Te nowe wyzwania doprowadziły do rozwoju mechaniki kwantowej, która stała się podstawą do opracowania nowego modelu atomu, znanego jako model atomowy Schrödingera.
Mechanika kwantowa, rozwijana na początku XX wieku, zrewolucjonizowała nasze rozumienie świata atomowego. Kluczowe dla mechaniki kwantowej są dwa fundamentalne pojęcia⁚ dualizm korpuskularno-falowy i zasada nieoznaczoności Heisenberga. Dualizm korpuskularno-falowy, sformułowany przez de Brogliego, stwierdza, że cząstki, takie jak elektrony, wykazują zarówno właściwości falowe, jak i korpuskularne. Oznacza to, że elektrony mogą zachowywać się jak fale, rozprzestrzeniając się w przestrzeni, a jednocześnie jak cząstki, posiadające określoną masę i ładunek.
Zasada nieoznaczoności Heisenberga stwierdza, że nie można jednocześnie określić z dowolną dokładnością położenia i pędu cząstki. Oznacza to, że im dokładniej znamy położenie cząstki, tym mniej precyzyjnie znamy jej pęd, i odwrotnie. Zasada ta ma fundamentalne znaczenie dla mechaniki kwantowej, ponieważ pokazuje, że nie można opisać ruchu cząstki w sposób deterministyczny, tak jak w mechanice klasycznej.
3.Hipoteza de Brogliego⁚ Dwuistotność falowo-korpuskularna materii
W 1924 roku Louis de Broglie wysunął hipotezę, że wszystkie cząstki materialne, w tym elektrony, posiadają również właściwości falowe. Hipoteza ta była oparta na analogii między falami elektromagnetycznymi a cząstkami, które zostały udowodnione przez Einsteina w jego teorii efektów fotoelektrycznych. De Broglie zasugerował, że długość fali λ związanej z cząstką o pędzie p jest dana równaniem⁚
gdzie h jest stałą Plancka. Hipoteza de Brogliego została potwierdzona eksperymentalnie w 1927 roku przez Davissona i Germera, którzy zaobserwowali dyfrakcję elektronów na krysztale niklu. Odkrycie to miało fundamentalne znaczenie dla rozwoju mechaniki kwantowej, ponieważ pokazało, że elektrony nie są tylko cząstkami, ale również falami.
Zrozumienie budowy atomu stanowiło od wieków jedno z najważniejszych wyzwań dla fizyki. Początkowo, w XIX wieku, dominował model atomu jako niepodzielnej, stałej cząstki. Jednak odkrycia fizyki atomowej, takie jak zjawisko promieniotwórczości i widma emisyjnego, zmusiły naukowców do rewizji tego poglądu. Pierwszym modelem atomowym, który uwzględniał strukturę wewnętrzną atomu, był model atomowy Thomsona, zaproponowany w 1904 roku. Model ten zakładał, że atom jest sferą naładowaną dodatnio, w której osadzone są elektrony o ładunku ujemnym. Jednak model Thomsona nie potrafił wyjaśnić stabilności atomu i istnienia widma emisyjnego.
Przełom w fizyce atomowej nastąpił w 1913 roku, kiedy Niels Bohr opublikował swój model atomowy. Model Bohra opierał się na założeniu, że elektrony poruszają się po orbitach wokół jądra atomowego, a ich energia jest skwantowana, co oznacza, że może przyjmować tylko dyskretne wartości. Model Bohra wyjaśniał widmo emisyjne atomu wodoru, ale miał też swoje ograniczenia, nie wyjaśniając np. widm atomów wieloelektronowych.
Model atomowy Bohra, mimo swojego sukcesu w wyjaśnieniu widma atomu wodoru, miał jednak swoje ograniczenia. Nie potrafił on wyjaśnić widm atomów wieloelektronowych, a także nie uwzględniał istotnych aspektów zachowania elektronów w atomie. Model Bohra zakładał, że elektrony poruszają się po określonych orbitach wokół jądra, co jest sprzeczne z zasadą nieoznaczoności Heisenberga, która stwierdza, że nie można jednocześnie określić z dokładnością położenia i pędu cząstki. Ponadto, model Bohra nie potrafił wyjaśnić zjawiska spinu elektronu ani istnienia orbitali atomowych.
Ograniczenia modelu atomowego Bohra stworzyły potrzebę opracowania nowego modelu atomu, który byłby w stanie wyjaśnić wszystkie znane wtedy zjawiska fizyczne związane z budową atomu. Te nowe wyzwania doprowadziły do rozwoju mechaniki kwantowej, która stała się podstawą do opracowania nowego modelu atomu, znanego jako model atomowy Schrödingera.
Mechanika kwantowa, rozwijana na początku XX wieku, zrewolucjonizowała nasze rozumienie świata atomowego. Kluczowe dla mechaniki kwantowej są dwa fundamentalne pojęcia⁚ dualizm korpuskularno-falowy i zasada nieoznaczoności Heisenberga. Dualizm korpuskularno-falowy, sformułowany przez de Brogliego, stwierdza, że cząstki, takie jak elektrony, wykazują zarówno właściwości falowe, jak i korpuskularne. Oznacza to, że elektrony mogą zachowywać się jak fale, rozprzestrzeniając się w przestrzeni, a jednocześnie jak cząstki, posiadające określoną masę i ładunek.
Zasada nieoznaczoności Heisenberga stwierdza, że nie można jednocześnie określić z dowolną dokładnością położenia i pędu cząstki. Oznacza to, że im dokładniej znamy położenie cząstki, tym mniej precyzyjnie znamy jej pęd, i odwrotnie. Zasada ta ma fundamentalne znaczenie dla mechaniki kwantowej, ponieważ pokazuje, że nie można opisać ruchu cząstki w sposób deterministyczny, tak jak w mechanice klasycznej.
3.Hipoteza de Brogliego⁚ Dwuistotność falowo-korpuskularna materii
W 1924 roku Louis de Broglie wysunął hipotezę, że wszystkie cząstki materialne, w tym elektrony, posiadają również właściwości falowe. Hipoteza ta była oparta na analogii między falami elektromagnetycznymi a cząstkami, które zostały udowodnione przez Einsteina w jego teorii efektów fotoelektrycznych; De Broglie zasugerował, że długość fali λ związanej z cząstką o pędzie p jest dana równaniem⁚
gdzie h jest stałą Plancka. Hipoteza de Brogliego została potwierdzona eksperymentalnie w 1927 roku przez Davissona i Germera, którzy zaobserwowali dyfrakcję elektronów na krysztale niklu. Odkrycie to miało fundamentalne znaczenie dla rozwoju mechaniki kwantowej, ponieważ pokazało, że elektrony nie są tylko cząstkami, ale również falami.
3.Zasada nieoznaczoności Heisenberga⁚ Granice precyzji w opisie cząstek
Zasada nieoznaczoności Heisenberga, sformułowana w 1927 roku, stanowi jedno z kluczowych praw mechaniki kwantowej. Stwierdza ona, że nie można jednocześnie określić z dowolną dokładnością położenia i pędu cząstki. Matematycznie, zasada ta wyraża się następującym równaniem⁚
gdzie Δx jest niepewnością położenia cząstki, Δp jest niepewnością jej pędu, a h jest stałą Plancka. Zasada ta ma fundamentalne znaczenie dla mechaniki kwantowej, ponieważ pokazuje, że nie można opisać ruchu cząstki w sposób deterministyczny, tak jak w mechanice klasycznej. W mechanice klasycznej można w zasadzie określić z dowolną dokładnością zarówno położenie, jak i pęd cząstki. W mechanice kwantowej natomiast, im dokładniej znamy położenie cząstki, tym mniej precyzyjnie znamy jej pęd, i odwrotnie.
Zrozumienie budowy atomu stanowiło od wieków jedno z najważniejszych wyzwań dla fizyki. Początkowo, w XIX wieku, dominował model atomu jako niepodzielnej, stałej cząstki. Jednak odkrycia fizyki atomowej, takie jak zjawisko promieniotwórczości i widma emisyjnego, zmusiły naukowców do rewizji tego poglądu. Pierwszym modelem atomowym, który uwzględniał strukturę wewnętrzną atomu, był model atomowy Thomsona, zaproponowany w 1904 roku. Model ten zakładał, że atom jest sferą naładowaną dodatnio, w której osadzone są elektrony o ładunku ujemnym. Jednak model Thomsona nie potrafił wyjaśnić stabilności atomu i istnienia widma emisyjnego.
Przełom w fizyce atomowej nastąpił w 1913 roku, kiedy Niels Bohr opublikował swój model atomowy. Model Bohra opierał się na założeniu, że elektrony poruszają się po orbitach wokół jądra atomowego, a ich energia jest skwantowana, co oznacza, że może przyjmować tylko dyskretne wartości. Model Bohra wyjaśniał widmo emisyjne atomu wodoru, ale miał też swoje ograniczenia, nie wyjaśniając np. widm atomów wieloelektronowych.
Model atomowy Bohra, mimo swojego sukcesu w wyjaśnieniu widma atomu wodoru, miał jednak swoje ograniczenia. Nie potrafił on wyjaśnić widm atomów wieloelektronowych, a także nie uwzględniał istotnych aspektów zachowania elektronów w atomie. Model Bohra zakładał, że elektrony poruszają się po określonych orbitach wokół jądra, co jest sprzeczne z zasadą nieoznaczoności Heisenberga, która stwierdza, że nie można jednocześnie określić z dokładnością położenia i pędu cząstki. Ponadto, model Bohra nie potrafił wyjaśnić zjawiska spinu elektronu ani istnienia orbitali atomowych.
Ograniczenia modelu atomowego Bohra stworzyły potrzebę opracowania nowego modelu atomu, który byłby w stanie wyjaśnić wszystkie znane wtedy zjawiska fizyczne związane z budową atomu. Te nowe wyzwania doprowadziły do rozwoju mechaniki kwantowej, która stała się podstawą do opracowania nowego modelu atomu, znanego jako model atomowy Schrödingera.
Mechanika kwantowa, rozwijana na początku XX wieku, zrewolucjonizowała nasze rozumienie świata atomowego. Kluczowe dla mechaniki kwantowej są dwa fundamentalne pojęcia⁚ dualizm korpuskularno-falowy i zasada nieoznaczoności Heisenberga. Dualizm korpuskularno-falowy, sformułowany przez de Brogliego, stwierdza, że cząstki, takie jak elektrony, wykazują zarówno właściwości falowe, jak i korpuskularne. Oznacza to, że elektrony mogą zachowywać się jak fale, rozprzestrzeniając się w przestrzeni, a jednocześnie jak cząstki, posiadające określoną masę i ładunek.
Zasada nieoznaczoności Heisenberga stwierdza, że nie można jednocześnie określić z dowolną dokładnością położenia i pędu cząstki. Oznacza to, że im dokładniej znamy położenie cząstki, tym mniej precyzyjnie znamy jej pęd, i odwrotnie. Zasada ta ma fundamentalne znaczenie dla mechaniki kwantowej, ponieważ pokazuje, że nie można opisać ruchu cząstki w sposób deterministyczny, tak jak w mechanice klasycznej.
3.Hipoteza de Brogliego⁚ Dwuistotność falowo-korpuskularna materii
W 1924 roku Louis de Broglie wysunął hipotezę, że wszystkie cząstki materialne, w tym elektrony, posiadają również właściwości falowe. Hipoteza ta była oparta na analogii między falami elektromagnetycznymi a cząstkami, które zostały udowodnione przez Einsteina w jego teorii efektów fotoelektrycznych. De Broglie zasugerował, że długość fali λ związanej z cząstką o pędzie p jest dana równaniem⁚
gdzie h jest stałą Plancka. Hipoteza de Brogliego została potwierdzona eksperymentalnie w 1927 roku przez Davissona i Germera, którzy zaobserwowali dyfrakcję elektronów na krysztale niklu. Odkrycie to miało fundamentalne znaczenie dla rozwoju mechaniki kwantowej, ponieważ pokazało, że elektrony nie są tylko cząstkami, ale również falami.
3.Zasada nieoznaczoności Heisenberga⁚ Granice precyzji w opisie cząstek
Zasada nieoznaczoności Heisenberga, sformułowana w 1927 roku, stanowi jedno z kluczowych praw mechaniki kwantowej. Stwierdza ona, że nie można jednocześnie określić z dowolną dokładnością położenia i pędu cząstki. Matematycznie, zasada ta wyraża się następującym równaniem⁚
gdzie Δx jest niepewnością położenia cząstki, Δp jest niepewnością jej pędu, a h jest stałą Plancka. Zasada ta ma fundamentalne znaczenie dla mechaniki kwantowej, ponieważ pokazuje, że nie można opisać ruchu cząstki w sposób deterministyczny, tak jak w mechanice klasycznej. W mechanice klasycznej można w zasadzie określić z dowolną dokładnością zarówno położenie, jak i pęd cząstki. W mechanice kwantowej natomiast, im dokładniej znamy położenie cząstki, tym mniej precyzyjnie znamy jej pęd, i odwrotnie.
Model atomowy Schrödingera, opublikowany w 1926 roku, stanowi matematyczny opis atomu oparty na mechanice kwantowej. Model ten opiera się na równaniu Schrödingera, które opisuje ewolucję w czasie funkcji falowej atomu. Funkcja falowa ψ jest wielkością matematyczną, która opisuje stan kwantowy atomu. Kwadrat funkcji falowej |ψ|² interpretuje się jako gęstość prawdopodobieństwa znalezienia elektronu w danym punkcie przestrzeni.
Równanie Schrödingera dla atomu wodoru ma postać⁚
gdzie ħ jest zredukowaną stałą Plancka, m jest masą elektronu, ∇² jest operatorem Laplace’a, V(r) jest potencjałem elektrostatycznym między elektronem a jądrem, a E jest energią atomu. Rozwiązanie równania Schrödingera dla atomu wodoru prowadzi do uzyskania funkcji falowych ψ i odpowiadających im poziomów energetycznych E. Funkcje falowe opisują kształt i rozkład prawdopodobieństwa znalezienia elektronu w przestrzeni, a poziomy energetyczne określają możliwe wartości energii, które może przyjmować elektron w atomie.
Model atomowy Schrödingera⁚ Podstawy teorii kwantowej
Wprowadzenie⁚ Ewolucja modeli atomowych
Zrozumienie budowy atomu stanowiło od wieków jedno z najważniejszych wyzwań dla fizyki. Początkowo, w XIX wieku, dominował model atomu jako niepodzielnej, stałej cząstki. Jednak odkrycia fizyki atomowej, takie jak zjawisko promieniotwórczości i widma emisyjnego, zmusiły naukowców do rewizji tego poglądu. Pierwszym modelem atomowym, który uwzględniał strukturę wewnętrzną atomu, był model atomowy Thomsona, zaproponowany w 1904 roku. Model ten zakładał, że atom jest sferą naładowaną dodatnio, w której osadzone są elektrony o ładunku ujemnym. Jednak model Thomsona nie potrafił wyjaśnić stabilności atomu i istnienia widma emisyjnego.
Przełom w fizyce atomowej nastąpił w 1913 roku, kiedy Niels Bohr opublikował swój model atomowy. Model Bohra opierał się na założeniu, że elektrony poruszają się po orbitach wokół jądra atomowego, a ich energia jest skwantowana, co oznacza, że może przyjmować tylko dyskretne wartości. Model Bohra wyjaśniał widmo emisyjne atomu wodoru, ale miał też swoje ograniczenia, nie wyjaśniając np. widm atomów wieloelektronowych.
Model atomowy Bohra⁚ Ograniczenia i potrzeby dalszych badań
Model atomowy Bohra, mimo swojego sukcesu w wyjaśnieniu widma atomu wodoru, miał jednak swoje ograniczenia. Nie potrafił on wyjaśnić widm atomów wieloelektronowych, a także nie uwzględniał istotnych aspektów zachowania elektronów w atomie. Model Bohra zakładał, że elektrony poruszają się po określonych orbitach wokół jądra, co jest sprzeczne z zasadą nieoznaczoności Heisenberga, która stwierdza, że nie można jednocześnie określić z dokładnością położenia i pędu cząstki. Ponadto, model Bohra nie potrafił wyjaśnić zjawiska spinu elektronu ani istnienia orbitali atomowych.
Ograniczenia modelu atomowego Bohra stworzyły potrzebę opracowania nowego modelu atomu, który byłby w stanie wyjaśnić wszystkie znane wtedy zjawiska fizyczne związane z budową atomu. Te nowe wyzwania doprowadziły do rozwoju mechaniki kwantowej, która stała się podstawą do opracowania nowego modelu atomu, znanego jako model atomowy Schrödingera.
Podstawy mechaniki kwantowej
Mechanika kwantowa, rozwijana na początku XX wieku, zrewolucjonizowała nasze rozumienie świata atomowego. Kluczowe dla mechaniki kwantowej są dwa fundamentalne pojęcia⁚ dualizm korpuskularno-falowy i zasada nieoznaczoności Heisenberga. Dualizm korpuskularno-falowy, sformułowany przez de Brogliego, stwierdza, że cząstki, takie jak elektrony, wykazują zarówno właściwości falowe, jak i korpuskularne. Oznacza to, że elektrony mogą zachowywać się jak fale, rozprzestrzeniając się w przestrzeni, a jednocześnie jak cząstki, posiadające określoną masę i ładunek.
Zasada nieoznaczoności Heisenberga stwierdza, że nie można jednocześnie określić z dowolną dokładnością położenia i pędu cząstki. Oznacza to, że im dokładniej znamy położenie cząstki, tym mniej precyzyjnie znamy jej pęd, i odwrotnie. Zasada ta ma fundamentalne znaczenie dla mechaniki kwantowej, ponieważ pokazuje, że nie można opisać ruchu cząstki w sposób deterministyczny, tak jak w mechanice klasycznej.
3.Hipoteza de Brogliego⁚ Dwuistotność falowo-korpuskularna materii
W 1924 roku Louis de Broglie wysunął hipotezę, że wszystkie cząstki materialne, w tym elektrony, posiadają również właściwości falowe. Hipoteza ta była oparta na analogii między falami elektromagnetycznymi a cząstkami, które zostały udowodnione przez Einsteina w jego teorii efektów fotoelektrycznych. De Broglie zasugerował, że długość fali λ związanej z cząstką o pędzie p jest dana równaniem⁚
gdzie h jest stałą Plancka. Hipoteza de Brogliego została potwierdzona eksperymentalnie w 1927 roku przez Davissona i Germera, którzy zaobserwowali dyfrakcję elektronów na krysztale niklu. Odkrycie to miało fundamentalne znaczenie dla rozwoju mechaniki kwantowej, ponieważ pokazało, że elektrony nie są tylko cząstkami, ale również falami.
3.Zasada nieoznaczoności Heisenberga⁚ Granice precyzji w opisie cząstek
Zasada nieoznaczoności Heisenberga, sformułowana w 1927 roku, stanowi jedno z kluczowych praw mechaniki kwantowej. Stwierdza ona, że nie można jednocześnie określić z dowolną dokładnością położenia i pędu cząstki. Matematycznie, zasada ta wyraża się następującym równaniem⁚
gdzie Δx jest niepewnością położenia cząstki, Δp jest niepewnością jej pędu, a h jest stałą Plancka. Zasada ta ma fundamentalne znaczenie dla mechaniki kwantowej, ponieważ pokazuje, że nie można opisać ruchu cząstki w sposób deterministyczny, tak jak w mechanice klasycznej. W mechanice klasycznej można w zasadzie określić z dowolną dokładnością zarówno położenie, jak i pęd cząstki. W mechanice kwantowej natomiast, im dokładniej znamy położenie cząstki, tym mniej precyzyjnie znamy jej pęd, i odwrotnie.
Model atomowy Schrödingera⁚ Opis matematyczny
Model atomowy Schrödingera, opublikowany w 1926 roku, stanowi matematyczny opis atomu oparty na mechanice kwantowej. Model ten opiera się na równaniu Schrödingera, które opisuje ewolucję w czasie funkcji falowej atomu. Funkcja falowa ψ jest wielkością matematyczną, która opisuje stan kwantowy atomu. Kwadrat funkcji falowej |ψ|² interpretuje się jako gęstość prawdopodobieństwa znalezienia elektronu w danym punkcie przestrzeni.
Równanie Schrödingera dla atomu wodoru ma postać⁚
gdzie ħ jest zredukowaną stałą Plancka, m jest masą elektronu, ∇² jest operatorem Laplace’a, V(r) jest potencjałem elektrostatycznym między elektronem a jądrem, a E jest energią atomu. Rozwiązanie równania Schrödingera dla atomu wodoru prowadzi do uzyskania funkcji falowych ψ i odpowiadających im poziomów energetycznych E. Funkcje falowe opisują kształt i rozkład prawdopodobieństwa znalezienia elektronu w przestrzeni, a poziomy energetyczne określają możliwe wartości energii, które może przyjmować elektron w atomie.
4.Równanie Schrödingera⁚ Podstawowe narzędzie teorii kwantowej
Równanie Schrödingera jest podstawowym narzędziem do opisu zachowania cząstek w mechanice kwantowej. Jest to równanie różniczkowe cząstkowe, które opisuje ewolucję w czasie funkcji falowej ψ cząstki. Funkcja falowa zawiera wszystkie informacje o stanie kwantowym cząstki, w tym o jej energii, pędzie i położeniu. Równanie Schrödingera ma postać⁚
gdzie ħ jest zredukowaną stałą Plancka, i jest jednostką urojoną, t jest czasem, a Ĥ jest operatorem hamiltonianu, który opisuje całkowitą energię cząstki. Rozwiązanie równania Schrödingera dla danej cząstki pozwala na określenie funkcji falowej i jej ewolucji w czasie, co umożliwia przewidywanie zachowania cząstki w danym układzie fizycznym.
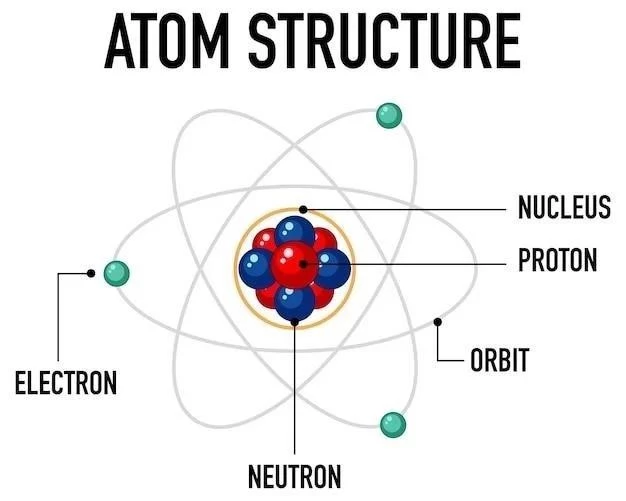
Artykuł jest dobrze zorganizowany i prezentuje jasny i zwięzły opis modelu atomowego Schrödingera.
Autor w sposób przystępny wyjaśnia zasady działania modelu atomowego Schrödingera, co czyni artykuł bardzo pożytecznym dla czytelnika.
Artykuł stanowi interesujące wprowadzenie do tematu modelu atomowego Schrödingera. Autor w sposób jasny i zwięzły przedstawia ewolucję modeli atomowych, od modelu Thomsona po model Bohra, co pozwala czytelnikowi lepiej zrozumieć kontekst historyczny i naukowy powstania modelu Schrödingera. Szczegółowe omówienie modelu Bohra i jego ograniczeń stanowi solidne podłoże dla wprowadzenia modelu Schrödingera.
Artykuł charakteryzuje się klarownym językiem i logicznym układem treści. Autor umiejętnie łączy historyczne aspekty rozwoju modeli atomowych z wyjaśnieniem zasadniczych cech modelu Schrödingera.
Autor umiejętnie łączy historyczne aspekty rozwoju modeli atomowych z wyjaśnieniem zasadniczych cech modelu Schrödingera, co czyni artykuł bardzo pouczającym.
Artykuł stanowi doskonałe wprowadzenie do tematu modelu atomowego Schrödingera, zwracając uwagę na jego znaczenie w rozwoju fizyki atomowej.
Artykuł stanowi doskonałe wprowadzenie do tematu modelu atomowego Schrödingera, prezentując jego kluczowe cechy i znaczenie w rozwoju fizyki atomowej.
Artykuł jest napisany w sposób jasny i zwięzły, co ułatwia zrozumienie zasadniczych cech modelu atomowego Schrödingera.
Autor precyzyjnie opisuje kluczowe cechy modelu atomowego Schrödingera, podkreślając jego znaczenie w rozwoju fizyki atomowej. W szczególności, autor zwraca uwagę na zastosowanie mechaniki kwantowej w opisie atomu, co stanowi istotny element zrozumienia tego modelu.
Autor w sposób przystępny przedstawia istotę modelu atomowego Schrödingera, wyjaśniając jego zalety w porównaniu do wcześniejszych modeli.
Autor w sposób dokładny i precyzyjny przedstawia model atomowy Schrödingera, wyjaśniając jego zastosowanie w fizyce atomowej.