Model atomowy Rutherforda⁚ Definicja‚ historia‚ eksperymenty i postulaty
Model atomowy Rutherforda‚ znany również jako model planetarny‚ został zaproponowany przez Ernesta Rutherforda w 1911 roku na podstawie jego słynnego eksperymentu rozpraszania cząstek alfa.
Wprowadzenie⁚ Atom jako podstawowa jednostka materii
Atom‚ jako podstawowa jednostka materii‚ stanowi niezwykle złożony i fascynujący obiekt badań naukowych. Od wieków naukowcy starali się rozwikłać tajemnice jego struktury i właściwości‚ co doprowadziło do powstania licznych modeli atomowych‚ z których każdy przybliżał nas do zrozumienia rzeczywistości na poziomie mikroświata. W 1803 roku John Dalton‚ opierając się na koncepcji atomizmu‚ sformułował swój model atomowy‚ który zakładał‚ że atomy są niepodzielnymi i niezniszczalnymi cząstkami. Jednakże‚ w miarę rozwoju nauki i pojawienia się nowych narzędzi badawczych‚ model Daltona okazał się niewystarczający do wyjaśnienia złożonych zjawisk zachodzących w materii.
Historia modeli atomowych
Rozwój modeli atomowych stanowi fascynującą historię odkryć naukowych i ewolucji naszego rozumienia struktury materii. Po modelu Daltona‚ który przedstawiał atom jako kulistą i niepodzielną cząstkę‚ pojawił się model atomowy Thomsona (1904). Thomson‚ opierając się na odkryciu elektronu‚ zaproponował‚ że atom składa się z dodatnio naładowanej kuli‚ w której zanurzone są elektrony o ładunku ujemnym. Model ten‚ znany jako model “pudełka z rodzynkami”‚ wyjaśniał pewne zjawiska‚ ale nie potrafił wyjaśnić wyników eksperymentu Rutherforda.
2.1. Model atomowy Daltona (1803)
Model atomowy Daltona‚ opracowany w 1803 roku‚ był pierwszym próbą opisania struktury atomu. Dalton‚ opierając się na koncepcji atomizmu‚ postulował‚ że atomy są niepodzielnymi i niezniszczalnymi cząstkami‚ które stanowią podstawową jednostkę materii. Według jego modelu‚ atomy danego pierwiastka są identyczne pod względem masy i właściwości‚ a atomy różnych pierwiastków różnią się od siebie. Dalton zaproponował również‚ że reakcje chemiczne polegają na przegrupowaniu atomów‚ a nie na ich tworzeniu lub niszczeniu. Model Daltona‚ choć prosty‚ stanowił znaczący krok naprzód w zrozumieniu budowy materii.
2.2. Model atomowy Thomsona (1904)
Model atomowy Thomsona‚ znany również jako model “pudełka z rodzynkami”‚ został zaproponowany w 1904 roku przez J.J. Thomsona‚ odkrywcę elektronu. Model ten zakładał‚ że atom składa się z dodatnio naładowanej kuli‚ w której zanurzone są elektrony o ładunku ujemnym. Elektrony te były rozmieszczone w kuli w sposób‚ który zapewniał neutralność elektryczną atomu. Model Thomsona był próbą wyjaśnienia struktury atomu w świetle nowych odkryć dotyczących elektronów‚ ale nie potrafił wyjaśnić niektórych zjawisk‚ takich jak rozpraszanie cząstek alfa przez atomy‚ które później zaobserwował Rutherford.
Eksperyment Rutherforda i odkrycie jądra atomowego
W 1911 roku Ernest Rutherford‚ wraz ze swoimi współpracownikami‚ przeprowadził przełomowy eksperyment‚ który doprowadził do odkrycia jądra atomowego i zrewolucjonizował nasze rozumienie struktury atomu. W tym eksperymencie‚ znanym jako eksperyment rozpraszania cząstek alfa‚ strumień cząstek alfa (jąder helu) został skierowany na cienką folię złotą. Oczekiwano‚ że cząstki alfa przejdą przez folię bez większych odchyleń‚ zgodnie z modelem atomowym Thomsona. Jednakże‚ wyniki eksperymentu były zaskakujące.
3.1. Eksperyment rozpraszania cząstek alfa
Eksperyment rozpraszania cząstek alfa‚ przeprowadzony przez Rutherforda i jego zespół‚ polegał na bombardowaniu cienkiej folii złotej strumieniem cząstek alfa. Cząstki alfa‚ będące jądrami atomów helu‚ emitowane były przez źródło radioaktywne. Zgodnie z modelem atomowym Thomsona‚ cząstki alfa powinny przechodzić przez folię złotą bez większych odchyleń‚ ponieważ atom był postrzegany jako rozproszony ładunek dodatni z zanurzonymi w nim elektronami. Jednakże‚ wyniki eksperymentu były zaskakujące.
3.2. Obserwacje i wnioski z eksperymentu
Podczas eksperymentu Rutherforda zaobserwowano‚ że większość cząstek alfa przechodziła przez folię złotą bez odchylenia‚ potwierdzając tym samym‚ że atomy są w większości puste. Jednakże‚ niewielka część cząstek alfa została rozproszona pod dużymi kątami‚ a nawet odbiła się od folii. To zjawisko było niezgodne z modelem atomowym Thomsona i wskazywało na istnienie w atomie małego‚ ale silnie naładowanego dodatnio obszaru‚ który odbijał cząstki alfa. Na podstawie tych obserwacji Rutherford wysnuł wniosek‚ że atom składa się z małego‚ dodatnio naładowanego jądra‚ w którym skupiona jest prawie cała masa atomu‚ oraz z elektronów poruszających się wokół jądra.
Model atomowy Rutherforda
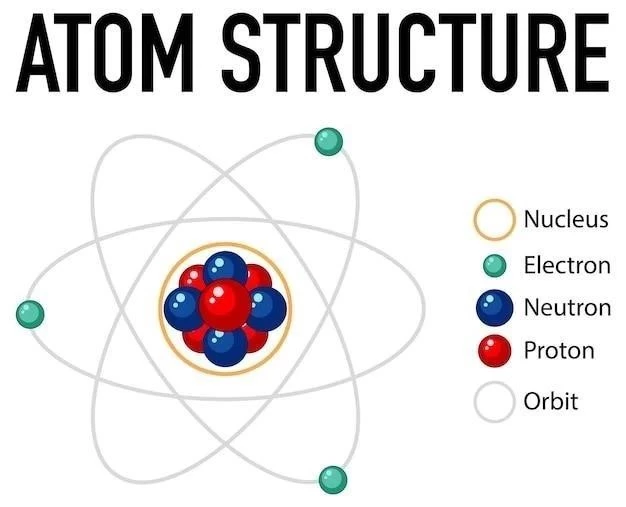
Model atomowy Rutherforda‚ znany również jako model planetarny‚ został zaproponowany w 1911 roku przez Ernesta Rutherforda na podstawie jego słynnego eksperymentu rozpraszania cząstek alfa. Model ten zakładał‚ że atom składa się z małego‚ dodatnio naładowanego jądra‚ w którym skupiona jest prawie cała masa atomu‚ oraz z elektronów poruszających się wokół jądra po orbitach podobnych do planet krążących wokół Słońca. Model Rutherforda był znaczącym krokiem naprzód w zrozumieniu struktury atomu‚ ale miał pewne ograniczenia‚ które później doprowadziły do rozwoju bardziej złożonych modeli atomowych;
4.1. Postulaty modelu atomowego Rutherforda
Model atomowy Rutherforda opierał się na kilku kluczowych postulatach⁚
- Atom składa się z małego‚ dodatnio naładowanego jądra‚ w którym skupiona jest prawie cała masa atomu.
- Jądro atomowe otoczone jest przez elektrony o ładunku ujemnym‚ poruszające się po orbitach wokół jądra.
- Większość objętości atomu jest pusta‚ ponieważ elektrony poruszają się po orbitach znacznie dalej od jądra.
- Siła elektrostatyczna między elektronami a jądrem utrzymuje atomy w całości.
4.2. Znaczenie modelu atomowego Rutherforda
Model atomowy Rutherforda‚ pomimo swoich ograniczeń‚ odegrał kluczową rolę w rozwoju fizyki atomowej. Był pierwszym modelem‚ który prawidłowo opisał strukturę atomu‚ wprowadzając pojęcie jądra atomowego. Odkrycie jądra atomowego miało fundamentalne znaczenie dla zrozumienia budowy materii i stanowiło podstawę do dalszych badań w dziedzinie fizyki atomowej i jądrowej. Model Rutherforda stanowił również punkt wyjścia dla rozwoju bardziej złożonych modeli atomowych‚ takich jak model atomowy Bohra‚ który uwzględniał kwantyzację energii elektronów.
Ograniczenia modelu atomowego Rutherforda
Model atomowy Rutherforda‚ mimo swojego znaczenia‚ miał pewne ograniczenia. Jednym z nich było to‚ że nie wyjaśniał stabilności atomu. Według praw klasycznej fizyki‚ elektrony poruszające się po orbitach wokół jądra powinny emitować promieniowanie elektromagnetyczne i tracić energię‚ co prowadziłoby do spiralnego ruchu w kierunku jądra i ostatecznego zderzenia z nim. Model Rutherforda nie wyjaśniał również widm emisyjnych atomów‚ czyli charakterystycznych wzorców fal elektromagnetycznych emitowanych przez atomy wzbudzone. Te ograniczenia modelu Rutherforda doprowadziły do rozwoju bardziej złożonych modeli atomowych‚ które uwzględniały zasady mechaniki kwantowej.
Rozwój modeli atomowych po Rutherfordzie
Ograniczenia modelu atomowego Rutherforda doprowadziły do rozwoju bardziej złożonych modeli atomowych‚ które uwzględniały zasady mechaniki kwantowej. W 1913 roku Niels Bohr‚ opierając się na pracach Maxa Plancka i Alberta Einsteina‚ zaproponował swój model atomowy‚ który wyjaśniał stabilność atomu i widma emisyjne. Model Bohra zakładał‚ że elektrony mogą poruszać się tylko po określonych orbitach o ściśle określonych poziomach energii. Przejście elektronu z jednego poziomu energii na inny wiązało się z emisją lub absorpcją kwantu energii w postaci fotonu. Model Bohra‚ choć stanowił znaczący krok naprzód‚ nie był w stanie wyjaśnić wszystkich zjawisk związanych z atomem.
6.1. Model atomowy Bohra (1913)
Model atomowy Bohra‚ zaproponowany w 1913 roku przez Nielsa Bohra‚ był próbą połączenia modelu Rutherforda z zasadami mechaniki kwantowej. Bohr zakładał‚ że elektrony mogą poruszać się tylko po określonych orbitach o ściśle określonych poziomach energii‚ zwanych poziomami energetycznymi. Przejście elektronu z jednego poziomu energetycznego na inny wiązało się z emisją lub absorpcją kwantu energii w postaci fotonu. Model Bohra wyjaśniał stabilność atomu i widma emisyjne atomów‚ ale nie był w stanie wyjaśnić wszystkich zjawisk związanych z atomem‚ takich jak struktura wieloelektronowych atomów.
6.2. Mechanika kwantowa i współczesne modele atomowe
Rozwój mechaniki kwantowej w latach dwudziestych XX wieku zrewolucjonizował nasze rozumienie atomu. Współczesne modele atomowe opierają się na zasadach mechaniki kwantowej‚ która opisuje zachowanie cząstek na poziomie atomowym. Według mechaniki kwantowej‚ elektrony nie poruszają się po określonych orbitach‚ ale raczej zajmują przestrzeń wokół jądra atomowego w postaci chmur elektronowych‚ zwanych orbitalami atomowymi. Orbital atomowy opisuje prawdopodobieństwo znalezienia elektronu w danym punkcie przestrzeni. Współczesne modele atomowe‚ takie jak model orbitalny‚ są w stanie wyjaśnić szeroki zakres zjawisk związanych z atomem‚ w tym strukturę wieloelektronowych atomów‚ widma emisyjne i absorpcyjne‚ a także reaktywność chemiczną.
Zastosowania wiedzy o atomie
Zrozumienie struktury atomu i jego właściwości ma fundamentalne znaczenie dla wielu dziedzin nauki i technologii. Wiedza ta znajduje zastosowanie w chemii‚ fizyce‚ medycynie‚ inżynierii materiałowej i wielu innych. Na przykład‚ znajomość struktury atomu pozwala na opracowywanie nowych materiałów o określonych właściwościach‚ takich jak wytrzymałość‚ przewodnictwo elektryczne‚ odporność na korozję. W medycynie‚ techniki obrazowania wykorzystujące promieniowanie radioaktywne‚ takie jak tomografia komputerowa (CT) i pozytronowa tomografia emisyjna (PET)‚ opierają się na wiedzy o atomie i jego właściwościach. Ponadto‚ wiedza o atomie jest niezbędna do zrozumienia procesów zachodzących w reaktorach jądrowych i w produkcji energii jądrowej.
Autor artykułu w sposób profesjonalny i zrozumiały przedstawia kluczowe aspekty modelu atomowego Rutherforda. Szczególnie wartościowe jest przedstawienie historii rozwoju modeli atomowych, co pozwala na lepsze zrozumienie kontekstu, w którym powstał model Rutherforda. Jednakże, warto byłoby rozszerzyć artykuł o bardziej szczegółowe omówienie ograniczeń modelu Rutherforda, a także o tym, jak został on później rozwinięty przez model Bohra.
Artykuł prezentuje rzetelne i przystępne omówienie modelu atomowego Rutherforda. Autor w sposób jasny i zwięzły przedstawia kluczowe postulaty modelu, a także opisuje eksperymenty, które doprowadziły do jego powstania. Warto docenić również wplecenie informacji o wcześniejszych modelach atomowych, co pozwala na lepsze zrozumienie ewolucji naszego pojmowania budowy atomu. Polecam ten artykuł wszystkim, którzy chcą pogłębić swoją wiedzę na temat budowy materii.
Artykuł prezentuje rzetelne i dobrze zorganizowane omówienie modelu atomowego Rutherforda. Autor w sposób jasny i zwięzły przedstawia kluczowe postulaty modelu, a także opisuje eksperymenty, które doprowadziły do jego powstania. Jednakże, warto byłoby rozszerzyć artykuł o bardziej szczegółowe omówienie zastosowań modelu Rutherforda w innych dziedzinach nauki, np. w chemii.
Artykuł stanowi wartościowe wprowadzenie do modelu atomowego Rutherforda. Autor w sposób klarowny i zwięzły przedstawia historię rozwoju modeli atomowych, co pozwala na lepsze zrozumienie kontekstu, w którym powstał model Rutherforda. Szczegółowy opis eksperymentu rozpraszania cząstek alfa oraz jego interpretacji jest bardzo pomocny w zrozumieniu kluczowych wniosków Rutherforda. Polecam ten artykuł wszystkim zainteresowanym tematyką budowy atomu.
Artykuł stanowi wartościowe wprowadzenie do modelu atomowego Rutherforda. Autor w sposób klarowny i zwięzły przedstawia historię rozwoju modeli atomowych, co pozwala na lepsze zrozumienie kontekstu, w którym powstał model Rutherforda. Szczegółowy opis eksperymentu rozpraszania cząstek alfa oraz jego interpretacji jest bardzo pomocny w zrozumieniu kluczowych wniosków Rutherforda. Jednakże, warto byłoby rozszerzyć artykuł o bardziej szczegółowe omówienie ograniczeń modelu Rutherforda, a także o tym, jak został on później rozwinięty przez model Bohra.
Artykuł prezentuje klarowne i zwięzłe przedstawienie modelu atomowego Rutherforda. Autor w sposób przystępny opisuje eksperyment rozpraszania cząstek alfa i jego znaczenie dla rozwoju naszego rozumienia budowy atomu. Jednakże, warto byłoby rozszerzyć artykuł o bardziej szczegółowe omówienie implikacji modelu Rutherforda dla rozwoju fizyki atomowej, a także o jego ograniczeniach.
Artykuł stanowi doskonałe wprowadzenie do modelu atomowego Rutherforda. Autor w sposób przystępny i zrozumiały przedstawia kluczowe postulaty modelu, a także opisuje eksperymenty, które doprowadziły do jego powstania. Szczególnie wartościowe jest przedstawienie historii rozwoju modeli atomowych, co pozwala na lepsze zrozumienie kontekstu, w którym powstał model Rutherforda. Polecam ten artykuł wszystkim zainteresowanym tematyką budowy atomu.