1.1. Atom jako Podstawowa Jednostka Materii
1.2. Budowa Atomu⁚ Protony, Neutrony i Elektrony
2.1. Liczba Atomowa (
Liczba atomowa (
2.2. Konfiguracja Elektronowa⁚ Układ Elektronów w Atomie
Konfiguracja elektronowa opisuje rozmieszczenie elektronów na poszczególnych powłokach i podpowłokach atomu.
2.3. Zasady Określania Konfiguracji Elektronowej
Konfiguracja elektronowa jest ustalana zgodnie z zasadami Aufbauu i Hunda.
3.1. Organizacja Elementów Według Liczby Atomowej
3.2. Okresy i Grupy⁚ Podział Elementów
3;3. Trendy Okresowe⁚ Właściwości Fizyczne i Chemiczne
4.1. Liczby Kwantowe⁚ Opis Stanu Elektronu
4.2. Orbitale Atomowe⁚ Przestrzenne Rozłożenie Elektronów
5.1. Poziomy Energetyczne Elektronów
5.2. Stan Podstawowy i Stan Pobudzony Atomu
6.1. Energia Jonizacji⁚ Energia Potrzebna do Usunięcia Elektronu
6.2. Elektroujemność⁚ Zdolność Atomu do Przyciągania Elektronów
7.1. Różnice w Liczbie Neutronów
7.2. Zastosowania Izotopów
8.1. Reakcje Jądrowe⁚ Zmiany w Jądrze Atomowym
8.2. Promieniotwórczość⁚ Rozpad Jąder Atomowych
9.1. Widmo Atomowe⁚ Charakterystyczne Linie Emisji i Absorpcji
9.2. Zastosowania Spektroskopii
10;1. Mechanika Kwantowa⁚ Opis Zachowania Elektronów w Atomie
10.2. Fizyka Atomowa⁚ Badanie Właściwości Atomów
1.1. Atom jako Podstawowa Jednostka Materii
1.2. Budowa Atomu⁚ Protony, Neutrony i Elektrony
2.1. Liczba Atomowa (
2.2. Konfiguracja Elektronowa⁚ Układ Elektronów w Atomie
2.3. Zasady Określania Konfiguracji Elektronowej
3.1. Organizacja Elementów Według Liczby Atomowej
3.2. Okresy i Grupy⁚ Podział Elementów
3.3. Trendy Okresowe⁚ Właściwości Fizyczne i Chemiczne
4.1. Liczby Kwantowe⁚ Opis Stanu Elektronu
4.2. Orbitale Atomowe⁚ Przestrzenne Rozłożenie Elektronów
5.1. Poziomy Energetyczne Elektronów
5.2. Stan Podstawowy i Stan Pobudzony Atomu
6.1. Energia Jonizacji⁚ Energia Potrzebna do Usunięcia Elektronu
6.2. Elektroujemność⁚ Zdolność Atomu do Przyciągania Elektronów
7.1. Różnice w Liczbie Neutronów
7.2. Zastosowania Izotopów
8.1. Reakcje Jądrowe⁚ Zmiany w Jądrze Atomowym
8.2. Promieniotwórczość⁚ Rozpad Jąder Atomowych
9.1. Widmo Atomowe⁚ Charakterystyczne Linie Emisji i Absorpcji
9.2. Zastosowania Spektroskopii
10.1. Mechanika Kwantowa⁚ Opis Zachowania Elektronów w Atomie
10.2. Fizyka Atomowa⁚ Badanie Właściwości Atomów
Atom jest najmniejszą jednostką materii, zachowującą wszystkie właściwości chemiczne danego pierwiastka. Składa się z jądra atomowego, które zawiera dodatnio naładowane protony i obojętne neutrony, oraz otaczającej je chmury elektronów o ładunku ujemnym. Liczba protonów w jądrze atomu określa jego liczbę atomową (
Atom jest podstawową jednostką materii, która zachowuje wszystkie właściwości chemiczne danego pierwiastka. Składa się z jądra atomowego, które zawiera dodatnio naładowane protony i obojętne neutrony, oraz otaczającej je chmury elektronów o ładunku ujemnym. Liczba protonów w jądrze atomu określa jego liczbę atomową (
1.1. Atom jako Podstawowa Jednostka Materii
Atom jest najmniejszą jednostką materii, która zachowuje wszystkie właściwości chemiczne danego pierwiastka. Jest to fundamentalny element składowy wszystkich substancji, zarówno prostych, jak i złożonych. Pomimo niewielkich rozmiarów, atom posiada złożoną strukturę wewnętrzną, która decyduje o jego zachowaniu i właściwościach.
Atom jest najmniejszą jednostką materii, która zachowuje wszystkie właściwości chemiczne danego pierwiastka. Jest to fundamentalny element składowy wszystkich substancji, zarówno prostych, jak i złożonych. Pomimo niewielkich rozmiarów, atom posiada złożoną strukturę wewnętrzną, która decyduje o jego zachowaniu i właściwościach.
1.2. Budowa Atomu⁚ Protony, Neutrony i Elektrony
2.1. Liczba Atomowa (
2.2. Konfiguracja Elektronowa⁚ Układ Elektronów w Atomie
2.3. Zasady Określania Konfiguracji Elektronowej
3.1. Organizacja Elementów Według Liczby Atomowej
3.2. Okresy i Grupy⁚ Podział Elementów
3.3. Trendy Okresowe⁚ Właściwości Fizyczne i Chemiczne
4.1. Liczby Kwantowe⁚ Opis Stanu Elektronu
4.2. Orbitale Atomowe⁚ Przestrzenne Rozłożenie Elektronów
5.1. Poziomy Energetyczne Elektronów
5.2. Stan Podstawowy i Stan Pobudzony Atomu
6.1. Energia Jonizacji⁚ Energia Potrzebna do Usunięcia Elektronu
6.2. Elektroujemność⁚ Zdolność Atomu do Przyciągania Elektronów
7.1. Różnice w Liczbie Neutronów
7.2. Zastosowania Izotopów
8.1. Reakcje Jądrowe⁚ Zmiany w Jądrze Atomowym
8.2. Promieniotwórczość⁚ Rozpad Jąder Atomowych
9.1. Widmo Atomowe⁚ Charakterystyczne Linie Emisji i Absorpcji
9.2. Zastosowania Spektroskopii
10.1. Mechanika Kwantowa⁚ Opis Zachowania Elektronów w Atomie
10.2. Fizyka Atomowa⁚ Badanie Właściwości Atomów
1.1. Atom jako Podstawowa Jednostka Materii
1;2. Budowa Atomu⁚ Protony, Neutrony i Elektrony
Atom składa się z jądra atomowego i otaczającej je chmury elektronów. Jądro atomowe zawiera protony i neutrony. Protony są dodatnio naładowane i decydują o liczbie atomowej elementu. Neutrony są obojętne elektrycznie i wpływają na masę atomową. Elektrony krążą wokół jądra i mają ładunek ujemny. Liczba elektronów w atomie jest równa liczbie protonów, co zapewnia neutralność elektryczną atomu.
Atom składa się z jądra atomowego i otaczającej je chmury elektronów. Jądro atomowe zawiera protony i neutrony. Protony są dodatnio naładowane i decydują o liczbie atomowej elementu. Neutrony są obojętne elektrycznie i wpływają na masę atomową. Elektrony krążą wokół jądra i mają ładunek ujemny. Liczba elektronów w atomie jest równa liczbie protonów, co zapewnia neutralność elektryczną atomu.
2.1. Liczba Atomowa (
2.2. Konfiguracja Elektronowa⁚ Układ Elektronów w Atomie
2.3. Zasady Określania Konfiguracji Elektronowej
3.1. Organizacja Elementów Według Liczby Atomowej
3.2. Okresy i Grupy⁚ Podział Elementów
3.3. Trendy Okresowe⁚ Właściwości Fizyczne i Chemiczne
4.1. Liczby Kwantowe⁚ Opis Stanu Elektronu
4.2. Orbitale Atomowe⁚ Przestrzenne Rozłożenie Elektronów
5.1. Poziomy Energetyczne Elektronów
5.2. Stan Podstawowy i Stan Pobudzony Atomu
6.1. Energia Jonizacji⁚ Energia Potrzebna do Usunięcia Elektronu
6.2. Elektroujemność⁚ Zdolność Atomu do Przyciągania Elektronów
7.1. Różnice w Liczbie Neutronów
7.2. Zastosowania Izotopów
8.1. Reakcje Jądrowe⁚ Zmiany w Jądrze Atomowym
8.2. Promieniotwórczość⁚ Rozpad Jąder Atomowych
9.1. Widmo Atomowe⁚ Charakterystyczne Linie Emisji i Absorpcji
9.2. Zastosowania Spektroskopii
10.1. Mechanika Kwantowa⁚ Opis Zachowania Elektronów w Atomie
10.2. Fizyka Atomowa⁚ Badanie Właściwości Atomów
1.1. Atom jako Podstawowa Jednostka Materii
1.2. Budowa Atomu⁚ Protony, Neutrony i Elektrony
2.1. Liczba Atomowa (
Liczba atomowa (
2.2. Konfiguracja Elektronowa⁚ Układ Elektronów w Atomie
Konfiguracja elektronowa opisuje rozmieszczenie elektronów na poszczególnych powłokach i podpowłokach atomu. Uwzględnia ona liczbę elektronów na każdym poziomie energetycznym i ich rozkład na orbitalach atomowych.
2.3. Zasady Określania Konfiguracji Elektronowej
Konfiguracja elektronowa jest ustalana zgodnie z zasadami Aufbauu i Hunda.
3.1. Organizacja Elementów Według Liczby Atomowej
3.2. Okresy i Grupy⁚ Podział Elementów
3.3. Trendy Okresowe⁚ Właściwości Fizyczne i Chemiczne
4.1. Liczby Kwantowe⁚ Opis Stanu Elektronu
4.2. Orbitale Atomowe⁚ Przestrzenne Rozłożenie Elektronów
5.1. Poziomy Energetyczne Elektronów
5.2. Stan Podstawowy i Stan Pobudzony Atomu
6.1. Energia Jonizacji⁚ Energia Potrzebna do Usunięcia Elektronu
6.2. Elektroujemność⁚ Zdolność Atomu do Przyciągania Elektronów
7;1. Różnice w Liczbie Neutronów
7.2. Zastosowania Izotopów
8.1. Reakcje Jądrowe⁚ Zmiany w Jądrze Atomowym
8.2. Promieniotwórczość⁚ Rozpad Jąder Atomowych
9.1. Widmo Atomowe⁚ Charakterystyczne Linie Emisji i Absorpcji
9.2. Zastosowania Spektroskopii
10.1; Mechanika Kwantowa⁚ Opis Zachowania Elektronów w Atomie
10.2. Fizyka Atomowa⁚ Badanie Właściwości Atomów
1.1. Atom jako Podstawowa Jednostka Materii
1.2. Budowa Atomu⁚ Protony, Neutrony i Elektrony
2.1. Liczba Atomowa (
Liczba atomowa (
2.2. Konfiguracja Elektronowa⁚ Układ Elektronów w Atomie
Konfiguracja elektronowa opisuje rozmieszczenie elektronów na poszczególnych powłokach i podpowłokach atomu.
2.3. Zasady Określania Konfiguracji Elektronowej
Konfiguracja elektronowa jest ustalana zgodnie z zasadami Aufbauu i Hunda.
3.1. Organizacja Elementów Według Liczby Atomowej
3.2. Okresy i Grupy⁚ Podział Elementów
3.3. Trendy Okresowe⁚ Właściwości Fizyczne i Chemiczne
4.1. Liczby Kwantowe⁚ Opis Stanu Elektronu
4.2. Orbitale Atomowe⁚ Przestrzenne Rozłożenie Elektronów
5.1. Poziomy Energetyczne Elektronów
5.2. Stan Podstawowy i Stan Pobudzony Atomu
6.1. Energia Jonizacji⁚ Energia Potrzebna do Usunięcia Elektronu
6.2. Elektroujemność⁚ Zdolność Atomu do Przyciągania Elektronów
7.1. Różnice w Liczbie Neutronów
7.2. Zastosowania Izotopów
8.1. Reakcje Jądrowe⁚ Zmiany w Jądrze Atomowym
8.2. Promieniotwórczość⁚ Rozpad Jąder Atomowych
9.1. Widmo Atomowe⁚ Charakterystyczne Linie Emisji i Absorpcji
9.2. Zastosowania Spektroskopii
10.1. Mechanika Kwantowa⁚ Opis Zachowania Elektronów w Atomie
10.2; Fizyka Atomowa⁚ Badanie Właściwości Atomów
1.1. Atom jako Podstawowa Jednostka Materii
1.2. Budowa Atomu⁚ Protony, Neutrony i Elektrony
2.1. Liczba Atomowa (
Liczba atomowa (
2.2. Konfiguracja Elektronowa⁚ Układ Elektronów w Atomie
Konfiguracja elektronowa opisuje rozmieszczenie elektronów na poszczególnych powłokach i podpowłokach atomu. Uwzględnia ona liczbę elektronów na każdym poziomie energetycznym i ich rozkład na orbitalach atomowych. Na przykład, konfiguracja elektronowa atomu węgla to
2.3. Zasady Określania Konfiguracji Elektronowej
Konfiguracja elektronowa jest ustalana zgodnie z zasadami Aufbauu i Hunda.
3.1. Organizacja Elementów Według Liczby Atomowej
3.2. Okresy i Grupy⁚ Podział Elementów
3.3. Trendy Okresowe⁚ Właściwości Fizyczne i Chemiczne
4.1. Liczby Kwantowe⁚ Opis Stanu Elektronu
4.2. Orbitale Atomowe⁚ Przestrzenne Rozłożenie Elektronów
5.1. Poziomy Energetyczne Elektronów
5.2. Stan Podstawowy i Stan Pobudzony Atomu
6.1. Energia Jonizacji⁚ Energia Potrzebna do Usunięcia Elektronu
6.2. Elektroujemność⁚ Zdolność Atomu do Przyciągania Elektronów
7.1. Różnice w Liczbie Neutronów
7.2. Zastosowania Izotopów
8.1. Reakcje Jądrowe⁚ Zmiany w Jądrze Atomowym
8.2. Promieniotwórczość⁚ Rozpad Jąder Atomowych
9.1. Widmo Atomowe⁚ Charakterystyczne Linie Emisji i Absorpcji
9.2. Zastosowania Spektroskopii
10.1. Mechanika Kwantowa⁚ Opis Zachowania Elektronów w Atomie
10.2. Fizyka Atomowa⁚ Badanie Właściwości Atomów
1.1. Atom jako Podstawowa Jednostka Materii
1.2. Budowa Atomu⁚ Protony, Neutrony i Elektrony
2.1. Liczba Atomowa (
Liczba atomowa (
2.2. Konfiguracja Elektronowa⁚ Układ Elektronów w Atomie
Konfiguracja elektronowa opisuje rozmieszczenie elektronów na poszczególnych powłokach i podpowłokach atomu.
2.3. Zasady Określania Konfiguracji Elektronowej
Konfiguracja elektronowa jest ustalana zgodnie z zasadami Aufbauu i Hunda. Zasada Aufbauu określa kolejność wypełniania orbitali przez elektrony, zaczynając od orbitali o najniższej energii. Zasada Hunda mówi, że elektrony najpierw zajmują pojedynczo każdy orbital na danej podpowłoce, a dopiero potem sparowują się na jednym orbitalu.
3.1. Organizacja Elementów Według Liczby Atomowej
3.2. Okresy i Grupy⁚ Podział Elementów
3.3. Trendy Okresowe⁚ Właściwości Fizyczne i Chemiczne
4.1. Liczby Kwantowe⁚ Opis Stanu Elektronu
4.2. Orbitale Atomowe⁚ Przestrzenne Rozłożenie Elektronów
5.1. Poziomy Energetyczne Elektronów
5.2. Stan Podstawowy i Stan Pobudzony Atomu
6.1. Energia Jonizacji⁚ Energia Potrzebna do Usunięcia Elektronu
6.2. Elektroujemność⁚ Zdolność Atomu do Przyciągania Elektronów
7.1. Różnice w Liczbie Neutronów
7.2. Zastosowania Izotopów
8.1. Reakcje Jądrowe⁚ Zmiany w Jądrze Atomowym
8.2. Promieniotwórczość⁚ Rozpad Jąder Atomowych
9.1. Widmo Atomowe⁚ Charakterystyczne Linie Emisji i Absorpcji
9.2. Zastosowania Spektroskopii
10.1. Mechanika Kwantowa⁚ Opis Zachowania Elektronów w Atomie
10.2. Fizyka Atomowa⁚ Badanie Właściwości Atomów
Wprowadzenie do Atomu
1. Podstawowe Pojęcia
1.1. Atom jako Podstawowa Jednostka Materii
1.2. Budowa Atomu⁚ Protony, Neutrony i Elektrony
2. Liczba Atomowa i Konfiguracja Elektronowa
2.1. Liczba Atomowa (
Liczba atomowa (
2.2. Konfiguracja Elektronowa⁚ Układ Elektronów w Atomie
Konfiguracja elektronowa opisuje rozmieszczenie elektronów na poszczególnych powłokach i podpowłokach atomu.
2.3. Zasady Określania Konfiguracji Elektronowej
Konfiguracja elektronowa jest ustalana zgodnie z zasadami Aufbauu i Hunda.
3. Układ Okresowy Pierwiastków
3.1. Organizacja Elementów Według Liczby Atomowej
Układ okresowy pierwiastków to graficzne przedstawienie wszystkich znanych pierwiastków chemicznych, uporządkowanych według rosnącej liczby atomowej. Pierwiastki o podobnych właściwościach chemicznych są umieszczone w kolumnach, zwanych grupami, a pierwiastki o podobnej liczbie powłok elektronowych znajdują się w wierszach, zwanych okresami.
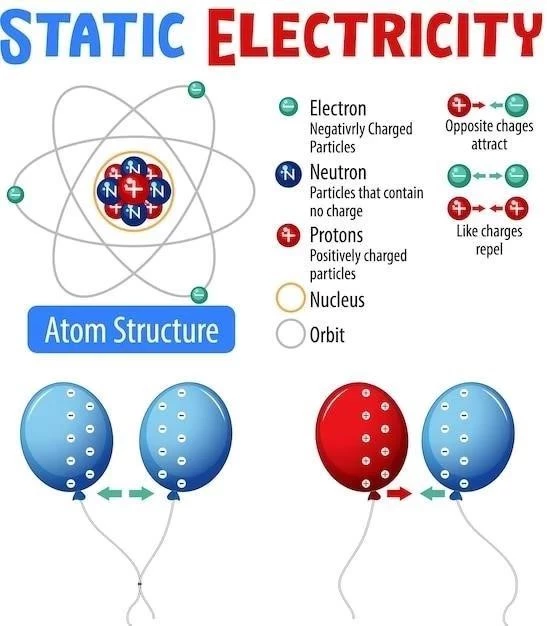
Artykuł przedstawia kompleksowe omówienie podstawowych pojęć i zasad dotyczących budowy atomu. Szczególnie cenne jest jasne i przejrzyste wyjaśnienie pojęć takich jak liczba atomowa, konfiguracja elektronowa, liczby kwantowe oraz orbitale atomowe. Dodatkowym atutem jest uwzględnienie zagadnień związanych z izotopami, reakcjami jądrowymi i spektroskopią atomową. Sugeruję rozważenie dodania krótkiego wprowadzenia do historii badań nad budową atomu, aby nadać kontekst omawianym zagadnieniom.
Artykuł jest napisany w sposób przystępny i zrozumiały, co czyni go wartościowym materiałem edukacyjnym. Szczególne uznanie zasługuje klarowne wyjaśnienie zasad określających konfigurację elektronową. Sugeruję dodanie krótkiego rozdziału poświęconego zastosowaniom wiedzy o budowie atomu w różnych dziedzinach nauki i techniki.
Artykuł stanowi doskonałe wprowadzenie do zagadnień związanych z budową atomu. Prezentacja materiału jest logiczna i dobrze zorganizowana, a użyte ilustracje i schematy graficzne ułatwiają zrozumienie omawianych pojęć. Warto byłoby rozszerzyć omawianie mechaniki kwantowej o bardziej szczegółowe przykłady, np. o zastosowania tej teorii w chemii kwantowej.
Artykuł stanowi doskonałe wprowadzenie do zagadnień związanych z budową atomu. Prezentacja materiału jest logiczna i dobrze zorganizowana, a użyte ilustracje i schematy graficzne ułatwiają zrozumienie omawianych pojęć. Warto byłoby rozszerzyć omawianie trendów okresowych o bardziej szczegółowe przykłady, np. o wpływ liczby elektronów walencyjnych na właściwości chemiczne pierwiastków.
Artykuł wyróżnia się kompleksowym i szczegółowym omówieniem zagadnień związanych z budową atomu. Prezentacja materiału jest logiczna i dobrze zorganizowana, a użyte ilustracje i schematy graficzne ułatwiają zrozumienie omawianych pojęć. Sugeruję rozważenie dodania krótkiego podsumowania i wniosków na zakończenie artykułu, aby utrwalić najważniejsze informacje.